Table of contents
- Gene therapy manufacturing comes of age: Commercial-scale manufacturing is imminent. Are gene therapy innovators ready?
- Overcoming obstacles in downstream bioprocessing of AAV based gene therapy products
- Overcoming challenges in the development of lentiviral vector manufacturing platforms
- Are modern scalable bioreactors the Cell Culture Strategy needed for Gene & Cell Therapy success?
- Le pouvoir magnétique des nanoparticules triage magnétique cellulaire dépollution des milieux et nano catalyseurs réutilisables
- Développement d’une nouvelle approche préventive pour réduire les infections microbiennes avec les nanoparticules d’oxydes métalliques
- Surveillance numérique de l’environnement : détecter les défaillances avant qu’elles ne se produisent
- Maximizing Sterility Assurance: Sterile Hold Time Testing for Sterilized Items Used in Parenteral Drug Manufacturing
La producción de terapia génica alcanza la mayoría de edad: la fabricación a escala comercial es inminente. ¿Están preparados los innovadores en terapia génica?
Primero poco a poco, y luego de golpe. Cuando Ernest Hemingway escribió estas palabras en Fiesta, desconocía la revolución de la terapia génica que se produciría casi un siglo después y, sin embargo, la describió a la perfección. Entre el primer borrador del genoma humano y la primera terapia génica in vivo aprobada por la FDA transcurrieron 16 años. Y ahora, de golpe, la FDA espera aprobar entre 10 y 20 productos de terapia celular y génica al año. Décadas de investigación nos han llevado a este momento y, muy pronto, las terapias génicas ocuparán un lugar central en la producción biotecnológica a escala comercial.
¿Cómo se están preparando los productores actuales de terapia génica para este cambio radical y qué barreras se interponen entre su trabajo innovador en el laboratorio y los pacientes que necesitan sus productos en el hospital? Casi la mitad de los participantes en la encuesta “Horizons” trabajan en este campo, así que decidimos preguntarles directamente. Sus respuestas dibujan el panorama de un submercado que está madurando rápidamente a medida que los investigadores se sienten cómodos superando límites, desarrollando e integrando nuevas tecnologías y sentando las futuras bases de la escalabilidad.
Coste de capital/financiación
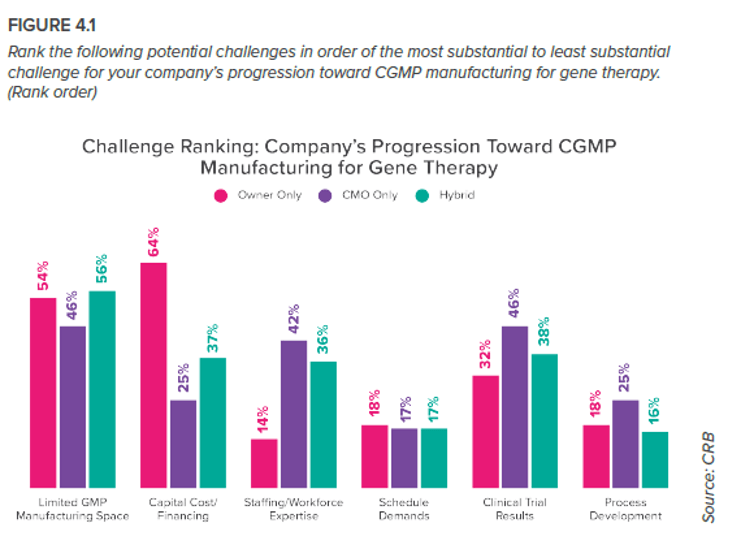
En conjunto, el submercado de la terapia génica recaudó 10 600 millones de dólares en inversiones de financiación de riesgo el año pasado, lo que supone un aumento interanual del 14 %. Sin embargo, como muestra la Figura 4.1, las empresas promotoras de los proyectos ven la financiación como un reto mucho mayor que las empresas de fabricación por contrato (CMO, por sus siglas en inglés) . Tal vez se deba a que estas empresas suelen operar en un marco empresarial diferente. Tienen sus propias instalaciones, pero no sus propios productos; en lugar de enfrentarse a la presión de financiar ensayos clínicos, construir infraestructuras y preparar el lanzamiento comercial, se centran en entregar lotes programados y gestionar una carga de producción completa.
Resultados de los ensayos clínicos
Nos sorprendió que este desafío no ocupara un puesto más alto. Los buenos resultados en los ensayos generan financiación, que se destina a las instalaciones de producción, las cuales a su vez facilitan la fabricación a gran escala para abastecer futuros ensayos. De esta manera, la rueda de la terapia génica sigue girando, con los ensayos clínicos como eje central. Es lógico que las CMO se preocupen más que nadie por esta variable, porque su carga de producción depende del incremento del volumen de pedidos de la empresa cliente, que a su vez depende del resultado de los ensayos clínicos. Por supuesto, las empresas promotoras de los proyectos son las más afectadas, especialmente en un clima en el que los reguladores abordan las terapias génicas con la debida cautela. Para lograr la aprobación comercial, las empresas promotoras necesitan resultados de ensayos clínicos que convenzan a los reguladores de la seguridad y eficacia terapéutica única de su producto. Y si el mercado ya ofrece un producto equiparable, la aprobación es improbable. Tal vez las empresas promotoras lo consideren un factor tan obvio de su éxito que hayan preferido centrarse en otras preocupaciones al responder a esta pregunta. Aunque las CMO y las promotoras experimentan muchos de estos retos de forma diferente, tienen algo en común: la dependencia mutua. En el sector de las ciencias de la vida en general, pero sobre todo en el emergente ámbito de las terapias génicas, la relación CMO-empresa promotora suele ser clave para el éxito futuro, lo que significa que esta merece un examen detenido.
1. Cómo evalúan los fabricantes de terapia génica las posibles CMO
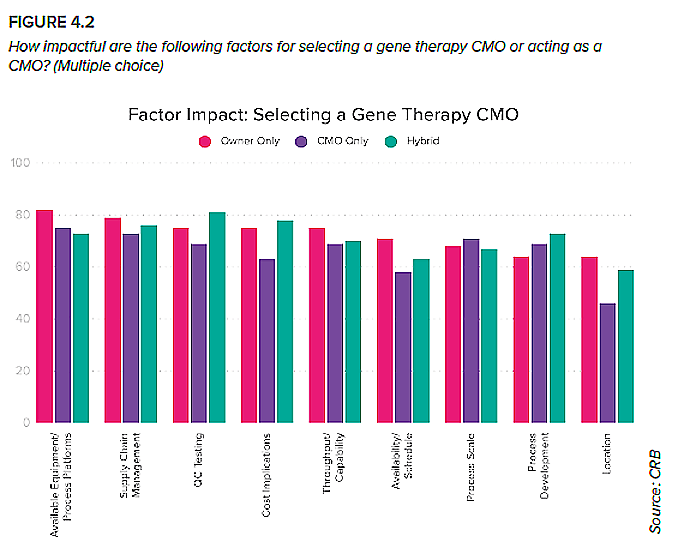
Preguntamos tanto a empresas promotoras como a terceros fabricantes del submercado de la terapia génica sobre los factores que consideran más importantes a la hora de seleccionar o actuar como CMO. Como se desprende, prácticamente todo es relevante; estos resultados uniformes señalan la existencia de una fuerte competencia actualmente en el ámbito de la producción de terapias génicas (Figura 4.2).
A las CMO les puede resultar útil analizar estos resultados en busca de oportunidades para diferenciar su oferta de servicios. En particular:
- Equipos/plataformas de proceso disponibles
Conforme la línea de investigación se va consolidando y las empresas promotoras se acercan al lanzamiento del producto, también maduran las plataformas de producción estandarizadas con potencial para respaldar la producción rápida de terapia génica a escala comercial. Los fabricantes por contrato deben alinear de forma proactiva sus capacidades de proceso con estas tecnologías emergentes; esto atraerá a empresas promotoras que necesitan un fabricante que pueda acelerar su comercialización con una plataforma eficaz y escalable.
- Gestión de la cadena de suministro
Este es un punto de fricción compartido por todos. Las CMO podrían diferenciarse, por ejemplo, almacenando componentes de un solo uso para varios meses o ampliando sus capacidades de producción para incluir plásmidos (más adelante se hablará de ello).
- Pruebas de control de calidad
De todo el proceso de producción, esta es una de las operaciones que las empresas promotoras suelen preferir externalizar. Al potenciar sus capacidades en pruebas de control de calidad, las CMO se podrían posicionar de forma ventajosa, actuando tanto como un recurso esencial como un socio potencial de solución llave en mano para empresas.
2. Las claves de la comercialización: habilidades escalables y de nueva generación
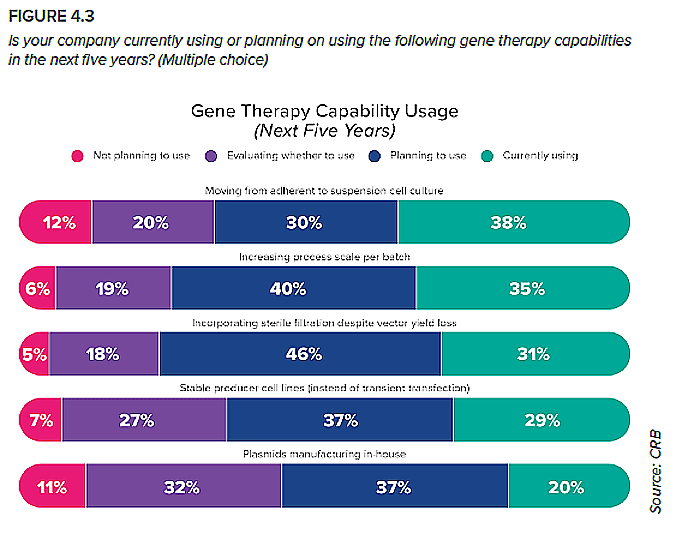
Ya sean CMO o promotoras, ¿qué están haciendo los innovadores en terapias génicas en este momento para prepararse para las grandes escalas que harán falta para satisfacer la demanda comercial en el futuro? Para responder a esta pregunta, les presentamos a los encuestados un conjunto de capacidades prometedoras y les preguntamos cuáles utilizaban actualmente o pensaban utilizar en un futuro próximo (Figura 4.3). Cada una de estas capacidades tiene el potencial de mejorar drásticamente la eficiencia y la escalabilidad de la producción de terapias génicas. Para que funcionen, las empresas tendrán que hacer grandes inversiones en I+D e investigar las implicaciones en materia de instalaciones y normativa de la integración de estas futuras capacidades. A pesar de estos obstáculos, los datos de nuestra encuesta reflejan un fuerte impulso detrás de cada una de estas capacidades, lo cual resulta muy alentador para un submercado que apenas inició su andadura y ya está aprendiendo a correr.
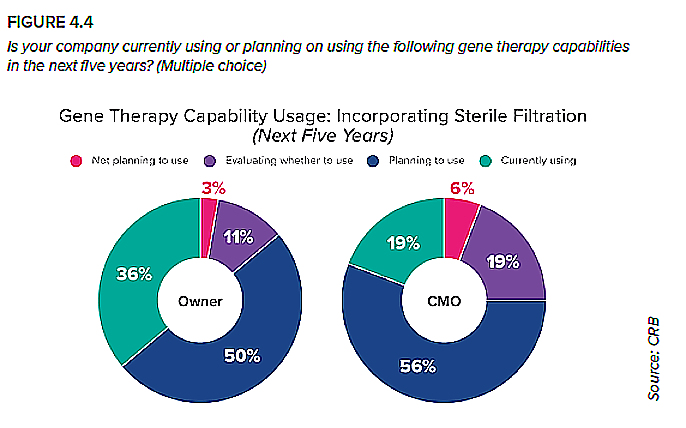
3. Filtración estéril
La filtración estéril, una herramienta afianzada en la fabricación de sustancias farmacológicas, podría suponer enormes ventajas para los fabricantes de terapia génica, como instalaciones más pequeñas y eficientes, menores costes operativos y oportunidades de cierre de procesos. Sin embargo, existe un importante hándicap potencial: los vectores lentivirales y retrovirales suelen sufrir una importante pérdida de rendimiento cuando se exponen a un filtro estéril.
Esta es probablemente la razón por la que solo un tercio de las empresas promotoras de los proyectos y una proporción todavía menor de CMO de nuestra encuesta utilizan actualmente un filtro estéril. Mientras fabriquen pequeños lotes de vectores virales para investigación preclínica o clínica temprana, una cabina de bioseguridad puede mantener el límite de procesamiento estéril necesario, sin afectar al rendimiento. Las empresas tendrían que adaptarse a los requisitos normativos del procesamiento aséptico. Esto significa que el nivel de procesamiento aséptico que suele reservarse para la fase de llenado y acabado debe extenderse a toda la cadena de procesos, lo cual resulta muy oneroso desde el punto de vista de la validación, la selección de equipos y el coste. Incluso si un fabricante pudiera justificarlo de algún modo en la sala de juntas, podría resultar inviable en la planta; muchas de las tecnologías utilizadas para la fabricación a mayor escala, como los sistemas de cromatografía, no se diseñaron para la producción aséptica. Esto probablemente esté influyendo en el gran segmento de propietarios y CMO que planean incorporar la filtración estéril en el futuro. Para que funcione, tendrán que optimizar el proceso para minimizar las pérdidas o incorporarlas a su estrategia de escalabilidad y planificar la cadena de producción en función de ellas. Es interesante observar que las CMO son menos propensas que las promotoras a utilizar la filtración estéril en su enfoque actual, pero ligeramente más propensas a planear (o sopesar) su adopción. Podría ser que las CMO hayan evitado históricamente la filtración estéril porque están centradas en maximizar sus rendimientos en lotes pequeños. Al mismo tiempo, han visto cómo las empresas promotoras están tomando la delantera en este sentido, lo que puede haberles incentivado recientemente a ponerse al día.
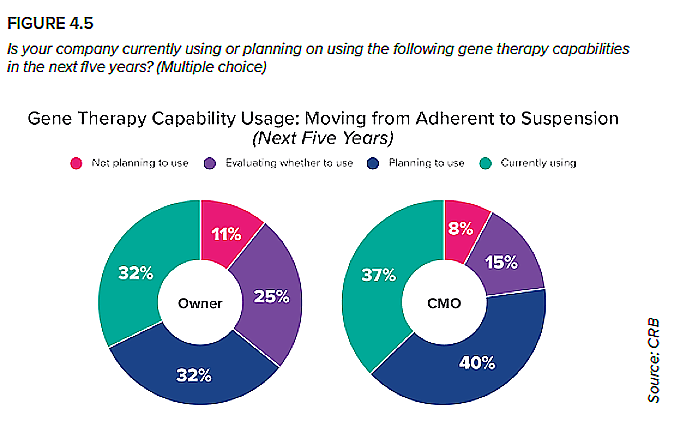
4. De las líneas celulares adherentes a las de suspensión
Las líneas celulares adherentes, que utilizan un punto de anclaje como el tejido o la superficie de una malla para reproducirse, requieren una superficie considerable, así como muchos operadores para llevar a cabo operaciones de lavado celular y expansión, y la posibilidad de un extenso procesamiento abierto. Muchos de nuestros encuestados han sorteado estos obstáculos mediante la transición a cultivos celulares en suspensión, que permiten un mejor aprovechamiento del espacio operativo al tiempo que allanan el camino para el procesamiento cerrado y automatizado. Asimismo, está el beneficio de la experiencia: los productores de terapia génica pueden aprender del camino trazado por los productores de proteínas terapéuticas, que aprovecharon este enfoque para transicionar desde el laboratorio al mercado hace tres décadas.
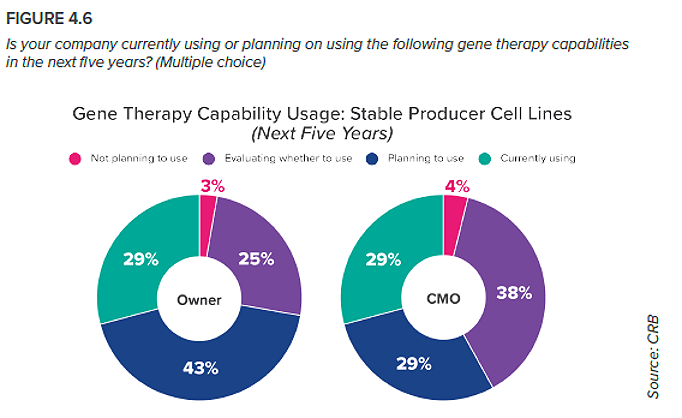
5. Líneas celulares productoras estables (en lugar de transfección transitoria)
Aunque actualmente es una tecnología más consolidada que las líneas celulares productoras estables, la transfección transitoria es un método difícil de sostener a medida que aumentan las cantidades de producción. Requiere grandes volúmenes de material transgénico en bruto, lo que encarece los costes, y depende de una dinámica química compleja dentro del biorreactor. Si se deciden por la transfección transitoria para alcanzar la producción comercial, los productores se hallarán con una eficiencia restringida y costes de producción elevados, y dependerán de una cadena de suministro de transgenes que tiene dificultades para satisfacer las exigencias. En cambio, un banco altamente productivo de células productoras estables ofrece la posibilidad de un proceso más eficaz, rentable y escalable. Aún no hemos visto esta tecnología plenamente implantada, pero el concepto general se parece mucho a la biotecnología clásica: a medida que los fabricantes cultivan una línea celular, pueden cultivar al mismo tiempo el elemento transgénico. Sin embargo, antes de que este enfoque se convierta en un pilar de la producción de terapias génicas, las empresas necesitan averiguar cómo diseñar células capaces de fabricar el vector sin ser transfectadas a escala. Las CMO parecen estar liderando este esfuerzo de I+D. Aunque actualmente es más probable que las promotoras ya dispongan de líneas celulares estables, casi el 90 % de las CMO están planeando adoptar este enfoque o están evaluando activamente su potencial como vía para una mayor escalabilidad. Las CMO que ya poseen una línea celular estable, aunque son pocas, están avanzadas respecto a la curva de adopción; esto posiblemente forme parte estratégica de su posición como socios listos para la comercialización de soluciones integrales.
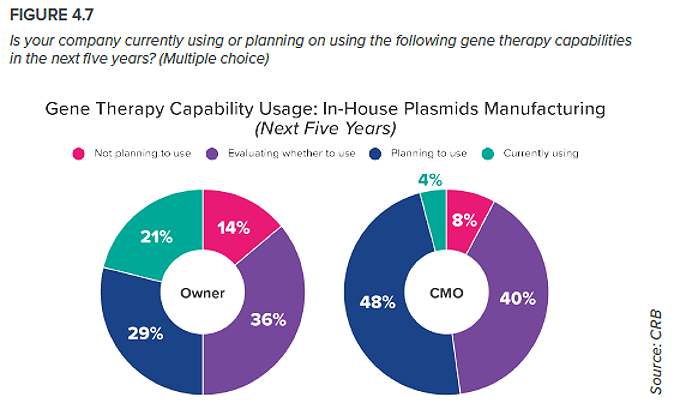
6. Producción interna de plásmidos
Solo unas pocas empresas en todo el mundo son capaces de fabricar esta materia prima esencial, lo que ha provocado un cuello de botella crónico en la cadena de suministro.
Es probable que esta sea la razón por la que nuestros encuestados muestran un marcado interés en internalizar el abastecimiento de sus plásmidos. Es una propuesta compleja que exigirá mucho I+D, pero controlar la disponibilidad, la calidad y el coste de unos materiales tan esenciales es un gran incentivo. Para las CMO, esta tendencia podría cambiar las reglas del juego. Como muestran los datos, pocas producen actualmente plásmidos, aunque el interés es grande. Quienes añadan esta capacidad en el futuro podrían disfrutar de una gran ventaja competitiva.
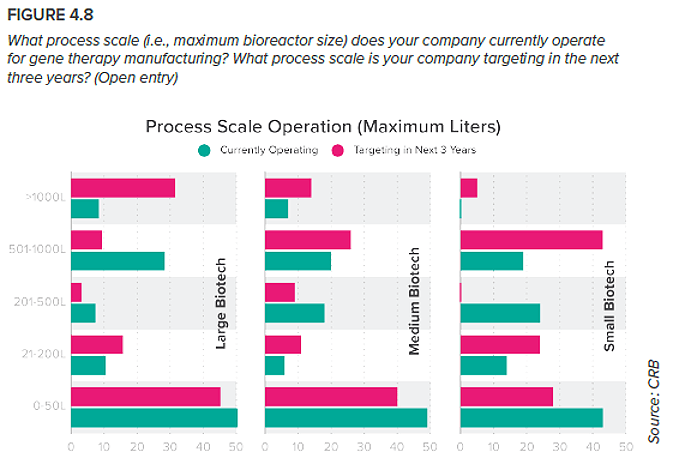
7. ¿Cómo se presenta la escalabilidad del proceso para los productores de terapia génica?
Hay una razón por la que las capacidades emergentes descritas anteriormente están atrayendo tanta atención entre los encuestados. El cambio está llegando rápidamente a este submercado y los investigadores en terapia génica se ven presionados para cambiar a su vez. Tanto si están bien establecidas como si acaban de empezar, la mayoría de las empresas que se dedican hoy a la investigación en terapia génica producen los lotes a pequeña escala necesarios para ensayos tanto preclínicos como iniciales. Incluso los estudios de terapia celular en fase inicial que dependen de un componente de terapia génica no suelen requerir grandes lotes de material crítico. Esta visión de producción a pequeña escala en laboratorio demuestra que la industria de la terapia génica se encuentra en fase incipiente. Pero, como podemos ver en la Figura 4.8, la mayoría de los encuestados esperan aumentar considerablemente sus volúmenes de producción en los próximos tres años. Las grandes empresas biotecnológicas son especialmente ambiciosas en sus objetivos de procesamiento, quizá porque pueden aprovechar la infraestructura existente para acelerar la ampliación, o quizá porque es más probable que se dirijan a patologías con una gran población de pacientes, frente a enfermedades raras o huérfanas con un mercado más pequeño. Algunos de los encuestados representados en la Figura 4.8 se abrirán camino en el eje Y utilizando enfoques establecidos como la transfección transitoria, pero los que inviertan pronto en capacidades más innovadoras y escalables estarán mejor preparados para entrar en el mercado comercial.
8. Compliance científica: ¿cómo abordan el riesgo los productores de terapia génica?
La fabricación de terapia génica a escala comercial requiere una cuidadosa evaluación de riesgos y un enfoque de producción que equilibre la eficiencia con la calidad y el control. Encontrar ese equilibrio no es fácil, y asegurarlo al gusto de un organismo regulador cauteloso puede ser aún más difícil. Desde ese punto de vista, nos sorprendió ver que la mayoría de los encuestados declararon sentirse relativamente cómodos con la producción de vectores. Esto podría reflejar la composición de los destinatarios de nuestra encuesta: como hemos señalado, la mayoría de los encuestados se encuentran en roles de etapas iniciales de I+D y de desarrollo de procesos, lo que significa que están operando antes de los estrictos programas de calidad que rigen las Buenas Prácticas de Fabricación (cGMP). Es posible que unos niveles de comodidad tan elevados puedan sobrevivir a un cambio del laboratorio a la planta a escala comercial, aunque es poco probable que ocurra rápidamente. La fabricación de vectores virales para diferentes productos en la misma sala, aunque quizá sea científicamente posible e ideal en términos de rendimiento eficiente, puede ser difícil de justificar desde una perspectiva reguladora sin una gestión de riesgos prohibitivamente rigurosa y un programa de calidad adecuado. Dentro de este panorama general, encontramos dos matices interesantes que merece la pena destacar:
- Los aisladores son algo más atractivos que las tecnologías de un solo uso.
Esto puede deberse a la actitud de que los componentes de un solo uso implican un riesgo elevado; a los fabricantes puede preocuparles que los componentes de plástico puedan desgastarse, por ejemplo, o que una conexión defectuosa pueda precipitar una fuga. Los aisladores, en cambio, son un sistema de contención validado. Para las operaciones de alto riesgo, los encuestados pueden optar por asumir el gasto adicional de la tecnología de aisladores. Es probable que esta actitud cambie a lo largo de la próxima década, a medida que los fabricantes y los organismos reguladores se vayan acostumbrando a las tecnologías de un solo uso en la producción de terapia génica, lo que permitirá una mayor flexibilidad y cambios de producto más rápidos.
- Las CMO tienen una mayor tolerancia al riesgo que las promotoras.
Dado que están familiarizadas con la práctica de gestionar varios clientes dentro de una misma instalación, es posible que las CMO ya dispongan de los controles y la validación necesarios para mitigar con seguridad los riesgos de cambiar de un producto a otro. Esto podría explicar por qué, en conjunto, respondieron más favorablemente que las promotoras en términos de tolerancia al riesgo. Para los pacientes que esperan una cura y para los fabricantes que se apresuran a llegar al mercado, el camino hacia unas terapias génicas eficaces y accesibles puede haber parecido largo. Aunque en segundo plano se está produciendo un cambio trascendental y rápido. Están surgiendo tecnologías escalables, como líneas celulares productoras estables y están cambiando las actitudes ante los riesgos y recompensas de la fabricación eficiente de terapias génicas. Asimismo, los innovadores están sentando las bases para enfoques comerciales personalizados que les ayudarán a tener éxito en el mercado. Como resultado, los fabricantes actuales de terapia génica están preparados para transformar la vida de millones de pacientes, primero poco a poco y luego de golpe.
Share the article