Sommaire
- ASTM E2500 : let's cross the Bridge !
- De l'étude du contexte à l'emploi de technologies de traitement des eaux adaptées
- Une nouvelle stratégie de gestion de l'eau en industrie pharmaceutique
- Cahier Pratique - Les boucles d'eau purifiée et la qualification. Focus sur la QP
- La mesure en continu dans l'eau à usage pharmaceutique (EUP)
- Candida auris, une espèce pathogène émergente "tueuse"
- Cleaning and disinfection program part of the lifecycle approach: a risk based rather arbitrarily imposed approach
- Eaux pharmaceutiques : les dessous de la maintenance des installations
- Pharma & the New Healthcare Economy. Ready or not ?
Le 24 juin 2016 le CDC (Center for Disease Control and Prevention) a publié une alerte exceptionnelle à l’intention des personnels de santé aux USA “leur demandant une vigilance particulière concernant les levures de l’espèce Candida auris chez les patients”. L’espèce de levure Candida auris a été décrite en 2009, à partir d’une unique souche isolée chez un patiente (décharge de l’oreille externe d’où le nom “auris”) dans un hôpital japonais (Satoh et al., 2009).

Les caractéristiques phénotypiques, chimiotaxonomiques et phylogénétiques (Fig1) suggéraient alors de manière évidente qu’il sagissait d’une nouvelle espèce affiliée au genre Candida (anamorphe) et donc à la classe des Ascomycète bien que la forme parfaite ne soit pas connue (téléomorphe).
En particulier, la séquence des gènes codant la région D1/D2 de l’ARNr 25S de la souche type de Candida auris était très significativement différente des séquences correspondantes pour les souches types des espèces alors décrites (85,7 % ; 83,0 % et 82,4 % d’homologie seulement avec Candida haemulonii, Candida pseudohaemulonii et Candida ruelliae, respectivement) (fig. 1). De même, la région ITS1/ITS2 de la souche type de C. auris montrait seulement 87,5 %; 81,4 %; et 81,3 % d’homologie avec la région correspondante des souches types de C. haemulonii, C. pseudohaemulonii et C.heveicola.
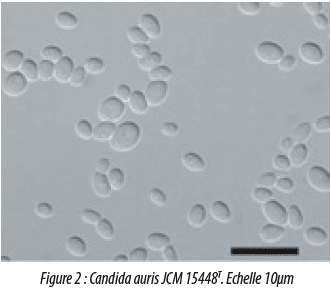
De plus cette espèce était caractérisée par son aptitude à croître à 42°C (mais pas à 45°C), et par sa résistance à différentes classes d’antifongiques (e.g. Azolés, 5-Flucytosine) et en présence de 50% de glucose et 10% de NaCl. Les cellules sont ovoïdes, (2-3 x 2-5 µm) (Fig2).
Epidémiologie
Depuis cette description initiale, un nombre croissant de cas d’infections graves des voies urinaires et respiratoires, voire systémiques, (mortelles dans 60-70% des cas) ont été rapportés dans la littérature au Japon, en Corée du Sud, en Inde, au Pakistan, en Afrique du Sud, au Koweit, au Venezuela et en Angleterre. Dans ce dernier cas une épidémie impliquant 40 patients dans une unité de soins intensifs, a persité malgré toutes les mesures de décontamination, l’isolement des patients, la fermeture du service, et autres mesures de contrôles accrus. Aux USA, plus de 70 cas ont été répertoriés entre juin 2016 et mai 2017, suite à l’alerte du CDC. Ces cas concernaient des patients de tous âges, le plus souvent présentant les facteurs de risque bien connus favorisant les infections invasives à levures (candidémies).
Il a été démontré par séquençage complet des génomes des souches représentatives des différentes régions géographiques (hors US), que 4 grands groupes génétiques sévissaient dans le monde (Pakistan-Inde; Afrique du Sud; Venezuela et Japon). Cependant dans une même zone géographique la majorité des isolats avaient une origine clonale (même souche) (Lockart et al. 2017).
Facteurs de pathogénicité
Outre la capacité des levures de cette espèce à croître à 42°C, la multi-résistance (à au moins deux antifongiques ou plus) a été observée pour pratiquement la moitié des isolats. Un faible pourcentage d’isolats était résistant aux trois classes d’antifongiques (Azolés, Polyènes et Echinocandines). Bien que les données moléculaires indiquent que le caractère de résistance aux antifongiques aurait émergé récemment et simultanément sur 3 continents, les épisodes épidémiques impliquant un même clone suggèrent une capacité de propagation et d’infection très différente de celles des levures pathogènes opportunistes classiques (Candida albicans, Candida glabrata, Candida krusei, Candida lusitaniae, Candida guilliermondii, Candida parapsilosis, etc.).
De plus, la persistence dans les environnements hospitaliers des souches de cette espèce, en particulier sur les surfaces en dépit des mesures de décontamination (désinfectant) a été démontrée. La contamination entre patients, sans contact, est également une évidence.
Diagnostic
il s’est avéré que l’identification à l’espèce était erronée avec les moyens conventionels (galeries API, testbiochimiques). Candida auris devrait être suspecté lorsque ses systèmes biochimiques ont généré une identification à Candida haemulonii (confusion fréquente). De même les identifications à Rhodotorula glutinis (avec colonie non-rose), à Candida sake (API 20C), à Candida catenulata (BD Phoenix); C. catenulata, C. famata, C. guilliermondii, ou C. lusitaniae (Microscan) sont sujettes à caution. Ceci pourrait avoir contribué à la non-détection de cette espèce par le passé.
Comment pouvons-nous alors identifier cette espèce ?
Récemment le système VITEK 2 YST (software 8.01) a été mis à jour et permet d’identifier Candida auris.
L’espèce n’était généralement pas présente dans les bases de données de spectre de masse pour les systèmes d’identification MALDI-TOF. Cependant, les systèmes Bruker et VitekMS permettent d’utiliser les bases de données “recherche” dans lesquelles l’espèce aura été implémentée, pour l’identifier fiablement par rapport aux autres espèces de Candida notamment.
Les méthodes d’identification par séquençage comparatif de la région D1/D2 ou de la région ITS permettent une identification absolument fiable de l’espèce. Nous avons dans nos bases de données (Eurofins IDmyk) les séquences de référence de souches représentatives de cette espèce (souche type et autres) et nous sommes en mesure d’ientifier cette espèce très efficacement. Le CDC préconise l’utilisation du séquençage comparatif pour l’identification des levures résistantes aux antifongiques et/ou identifiées de manière “ambiguës” aux espèces pré-citées selon les méthodes biochimiques ou protéomiques en absence de spectre de référence dans les bases de données.
Habitat
L’habitat naturel n’est pas connu.
Moyens de lutte
Le CDC recommande d’utiliser les désinfectants fongicides mais également, des désinfectants sporicides dont ceux éprouvés pour Clostridium difficile pour les surfaces en milieu hospitalier et dans les laboratoires.
Conclusion
L’émergence de cette espèce de levure Candida auris à l’échelle planétaire succite une importante angoisse, comme avant elle Cryptococcus neoformans, Cryptococcus gattii, Candida glabrata, Candida krusei, etc.
Cependant ces dernières ne cumulaient pas autant de facteurs favorables à une dissémination épidémique, ce qui a provoqué l’alerte exceptionnelle du CDC. Elle souligne notre vulnérabilité aux infections fongiques et les limites de notre arsenal thérapeutique. Elle met en évidence également le besoin d’identifier précisément les micro-organismes en général et les levures en particulier. Bien que les levures soient rarement un problème au niveau des industries pharmaceutiques (fréquence, occurence, non thermotolérance, etc.) nous en identifions régulièrement de différentes origines par séquençage comparatif.
Nous sommes parés et particulièrement vigilant quant à une possible identification de la levure “tueuse”.

Dr. Arnaud CARLOTTI – EUROFINS IDmyk
arnaudcarlotti@eurofins.com
Partager l’article
Bibliographie
Satoh, K., et al. “Candida auris sp. nov. a novel ascomycetous yeast isolated from the external ear canal of an inpatient in a japanese hospital”. Microbiol. Immunol. 2009; 53: 41-44
Lockhart, S. , et al. ” Simulteneous emergence of multi-drug-resistant candia auris on 3 continents confirmed by whole-genome sequencing and epidemiological analyses”. Clin. infect. Dis. 2017; 64:134-139
Clancy, C. J. and Nguyen M. H. “Emergence of Candida auris : an international call to arms”. Clin. infect. Dis. 2017; 64:141-143
CDC. Clinical alert to US Healthcare facilities. “Global emergence of invasive infections caused by the multidrug-resistant yeast Candida auris”. June 2016. https://www.cdc.gov/ fungal/diseases/candidiasis/candida-auris-alert.html
CDC. Candida auris “Interim recommendations for healthcare facilities and laboratories”. https://www.cdc.gov/fungal/diseases/candidiasis/recommendations.html