Comment déterminer les critères de qualification pour l’inspection visuelle des produits pharmaceutiques injectables : arbitrage entre une approche basée sur la criticité des défauts versus une approche probabiliste.
Une des étapes critiques permettant de garantir la qualité d’un produit injectable est l’inspection visuelle des unités remplies. Une inspection visuelle à 100% des produits injectables est nécessaire pour garantir la sécurité des patients, préserver l’efficacité des médicaments, optimiser les processus de fabrication et donc assurer la conformité du produit par rapport aux réglementations.
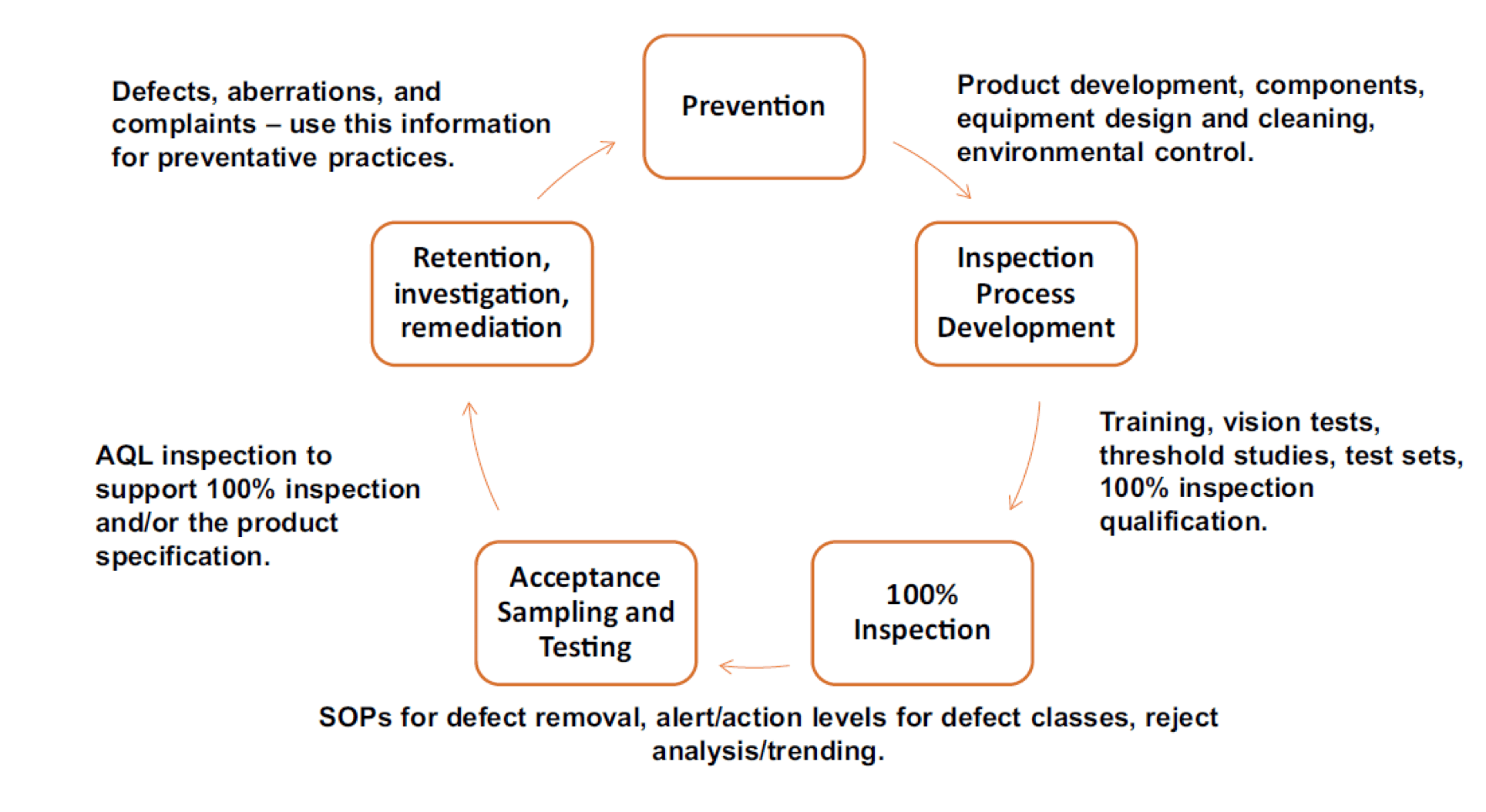
Bien que l’objectif de l’inspection visuelle à 100% soit de rechercher tous les types de défauts réels du procédé de fabrication, visibles par l’humain, les pharmacopées européennes, américaines, japonaises et chinoises, reconnaissent que la nature de ce procédé d’inspection visuelle est probabiliste, et ne demandent pas un taux de détection à 100% des défauts et ce même pour les défauts critiques.
Chaque pharmacopée recommande des procédés robustes et validés, ainsi qu’une amélioration continue du processus de fabrication du produit, car le procédé d’inspection visuelle à 100% n’est qu’une étape permettant de garantir la qualité du produit. Ces normes définissent également des Niveaux de Qualité Acceptable (NQA), permettant de mettre sur le marché un lot avec un faible niveau de défauts et reflétant un équilibre entre le risque pour le patient et les capacités de fabrication des produits pharmaceutiques.
Même si la plupart des réglementations mettent l’accent sur l’objectif de réduire au minimum le taux de défauts dans les produits pharmaceutiques injectables via un processus holistique de gestion de la qualité (incluant l’inspection visuelle à 100%), il s’agit d’un objectif et non d’une exigence de 0% de défauts dans un lot et ce quelle que soit leur criticité.
Toutefois, il existe parfois une confusion entre l’objectif de l’inspection visuelle à 100% d’un lot et la capacité du procédé d’inspection visuelle à détecter 100% des défauts critiques de manière réaliste et répétable, entrainant une exigence de détecter les défauts critiques à un taux de 100% lors des étapes de qualification du procédé.
Cet article a pour objectif de clarifier la nature probabiliste de l’inspection visuelle et les risques associés en cas de mauvaise interprétation ou rejet de cette approche probabiliste, et ce même pour les défauts critiques.
t
1. Le choix d’accepter une approche probabiliste pour le processus d’inspection visuelle des produits pharmaceutiques injectables est motivé par plusieurs facteurs
Limites et variabilités de l’inspection visuelle humaine :
Les inspecteurs sont soumis à des limitations physiques et cognitives. L’acuité visuelle varie d’une personne à une autre (même avec un test médical conforme) et peut être influencée par des facteurs tels que l’éclairage, le contraste avec l’arrière-plan, la fatigue, le stress, les propriétés physiques des contenants et des contenus inspectés (par exemple la couleur, la transparence ou les bulles dans un produit) et la récurrence du type de défauts rencontrés.
 |  |
Ces variabilités affectent leur capacité à détecter de manière systématique tous les types de défauts, en particulier ceux qui sont plus petits, nécessitant donc une approche probabiliste pour tenir compte de la variabilité et de la probabilité de détection.
Variabilité naturelle des défauts :
Les défauts visibles ne sont pas générés par le processus de fabrication selon un schéma prévisible et répétable. Les défauts retrouvés lors de l’inspection visuelle du lot peuvent varier considérablement en termes de taille, de forme, de localisation, de couleur et de matériau. Une approche probabiliste permet de prendre en compte ces variabilités naturelles du procédé de fabrication impactant leur détectabilité intrinsèque.
Probabilité et seuils de détection :
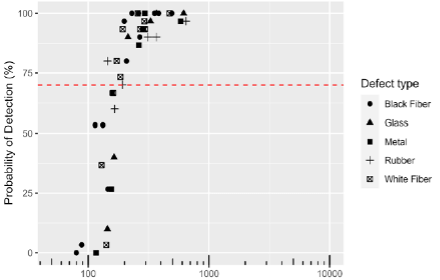
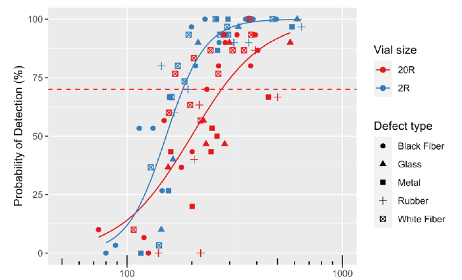
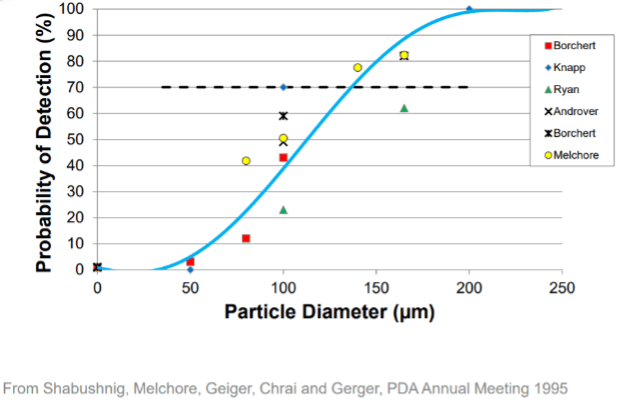
La probabilité de détecter un défaut, dans le champ du visible (par exemple, avec produit et flacon transparent < 10ml, 70% pour une taille supérieure à 100-150 µm) dépend non seulement des capacités de détection de l’inspecteur, mais aussi de nombreux facteurs, notamment le type de contenant, les propriétés du produit (par exemple la couleur, la viscosité, la présence de bulles ou l’état de surface pour les produits lyophilisés), les caractéristiques des défauts (par exemple la taille, la forme, la couleur, la localisation, les matériaux) et le niveau contraste avec l’arrière-plan.
Des défauts plus petits ou moins contrastés seront intrinsèquement plus difficiles à détecter que d’autres quel que soit leur niveau de sévérité pour le patient.
Une approche probabiliste permet d’intégrer ces complexités dans le processus d’inspection visuelle, reconnaissant que tous les défauts ne peuvent pas être détectés avec la même efficacité quel que soit leur niveau de sévérité pour le patient, car il n’existe aucune corrélation logique et scientifique entre la sévérité d’un défaut et sa détectabilité.
Particle size (µm)
PDA 2024 – From Blur to Clarity – Definition of particles visibility threshold in parenteral Drug products (vials)
Particle size (µm)
PDA 2024 – From Blur to Clarity – Definition of particles visibility threshold in parenteral Drug products (vials)
Limites technologiques :
Bien que la technologie actuelle des systèmes d’inspection visuelle automatisés puisse améliorer les capacités de détection des défauts, ces systèmes présentent encore des limites, même avec l’émergence de l’intelligence artificielle. Aucune technologie actuelle n’offre une capacité de détection à 100% des défauts réels du procédé de fabrication, surtout pour un large éventail de types de produits et de défauts.
Rigueur statistique :
Une approche probabiliste utilise des principes statistiques pour définir les critères de qualification, garantissant ainsi que le procédé d’inspection visuelle est basé sur un rationnel scientifique solide.
La validation des processus d’inspection visuelle basée sur une approche probabiliste permet une estimation plus robuste de la qualité et de la sécurité du lot.
Conformité réglementaire :
Les normes réglementaires, dans le cadre de l’inspection visuelle de produits pharmaceutiques injectables, acceptent l’utilisation d’une approche probabiliste en raison de son fondement statistique, alignée sur les bonnes pratiques de fabrication et normes de la qualité.
Les pharmacopées n’exigent pas un taux de détection des défauts de 100%, même pour les défauts critiques, reconnaissant ainsi les limites de l’inspection visuelle humaine et des technologies d’inspection automatisées.
Les normes réglementaires imposent souvent la validation des processus d’inspection visuelle par des méthodes statistiques. Une approche probabiliste fournit des données complètes et fiables, essentielles pour évaluer la capacité de détection des défauts du processus d’inspection visuelle. Cela permet d’évaluer correctement les risques afin d’assurer la conformité et la qualité des produits pharmaceutiques injectables.
Les lignes directrices visent à ce que les produits soient « essentiellement exempts » de défauts, tout en reconnaissant l’impraticabilité d’un scénario sans aucun défaut.
2. Risques liés à la confusion entre le processus d’inspection à 100% et un taux de détection à 100% pour les défauts critiques
Attentes irréalistes et risques qualité :
Prise de décision faussée lors de la gestion des risques et assurance qualité biaisée :
Supposer qu’une inspection visuelle à 100% d’un lot permet une détection de 100% des défauts critiques alors que ce n’est pas le cas, peut induire à une fausse évaluation de la qualité d’un lot.
Une mauvaise compréhension de la nature probabiliste de l’inspection visuelle peut nuire à la gestion efficace des risques. Accorder une importance excessive à la détection à 100% des défauts critiques peut conduire à des décisions inappropriées basées sur des données inexactes concernant l’efficacité du processus d’inspection visuelle et la qualité réelle du produit inspecté.
Validation d’un procédé avec des défauts non représentatifs des défauts critiques générés lors des étapes de fabrication du contentant et du produit :
Orienter la constitution du kit de qualification à l’inspection visuelle, afin que les défauts critiques soient visibles avec un taux de détection de 100%, représente un risque de déviation entre ce que l’opérateur ou la machine sont capables de détecter en condition de qualification et ce qu’ils sont capables de détecter lors de l’inspection finale du produit avant mise sur le marché.
Cet écart peut, au fil du temps et de la maintenance de la défauthèque de qualification (qui serait constituée de défauts critiques uniquement détectables à 100%), biaiser l’objectif du procédé d’inspection visuelle, qui est de garantir la qualité du produit délivré aux patients et de contribuer à l’amélioration continue du processus de fabrication.
Pression exercée sur les personnes exerçant l’inspection visuelle :
Exiger un taux de détection de 100% pour un défaut même critique, alors que des études statistiques ont démontré que la sensibilité de détection humaine est probabiliste, peut exercer une forme de pression excessive sur les inspecteurs, entraînant stress et épuisement professionnel. Paradoxalement, cette situation peut réduire l’efficacité des inspections au fil du temps, car des inspecteurs stressés risquent de faire plus d’erreurs. En outre, certains défauts pouvant impacter l’utilisation du produit ou la santé du patient pourraient être négligés lors de l’inspection finale du lot. Inversement, cela peut engendrer une augmentation du faux rejet.
Remise en question des résultats de l’étude statistique qui a servi de référence pour la qualification du procédé :
Qualifier des inspecteurs à détecter à 100% les défauts critiques de la défauthèque de qualification lorsque les résultats de l’étude de capabilité démontrent un résultat différent, pose la question naturelle de la pertinence des résultats de l’étude de capabilité à l’inspection visuelle qui a été réalisée afin de définir la défauthèque ainsi que les critères de qualification, car le niveau d’expérience des inspecteurs ayant réalisé l’étude statistique pourrait être remis en question :
- Par exemple, en suivant la méthode Knapp test, quels seraient les résultats, si l’étude de capabilité de détection était de nouveau réalisée avec ces inspecteurs ayant démontré récemment une aptitude à détecter à 100% les défauts critiques représentés dans la défauthèque de qualification à l’inspection visuelle ?
Manque de flexibilité :
Imposer un taux de détection de 100% pour certains défauts lors d’une phase de qualification, en l’absence de preuves statistiques, limite la flexibilité nécessaire pour s’adapter aux variations des défauts de production, tels que l’intégration de nouveaux défauts ou une re-caractérisation des défauts déjà connus du procédé.
Délivrer les produits pour les patients :
S’efforcer d’atteindre un taux de détection de 100% lorsqu’il n’est pas approprié nécessite des ressources supplémentaires et des équipements plus complexes, ce qui peut ralentir le processus de production (par exemple si peu d’opérateurs sont qualifiables) ou générer un taux de faux rejets élevé et compromettre donc les capacités d’approvisionnement des produits destinés aux patients.
Risques liés à la réglementation et à la conformité :
Insister excessivement sur l’obtention d’une détection à 100% pour certains défauts peut conduire à des pratiques non conformes aux bonnes pratiques de l’industrie scientifiquement reconnues, mettant ainsi à risque la conformité réglementaire.
3. Exemple d’un cas d’utilisateurs
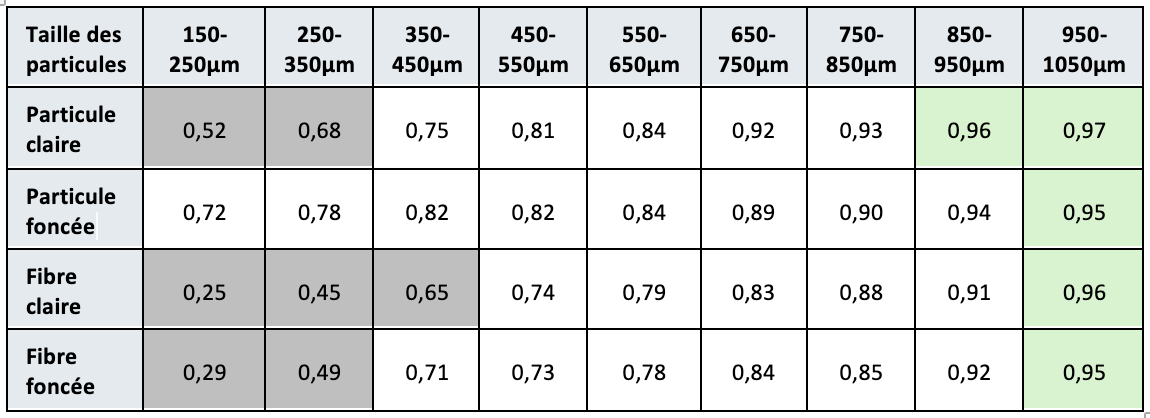
Les résultats d’une l’étude statistique de capabilité de détection à l’inspection visuelle d’un produit sont les suivants :
Exemple de probabilité de détection par taille de défauts
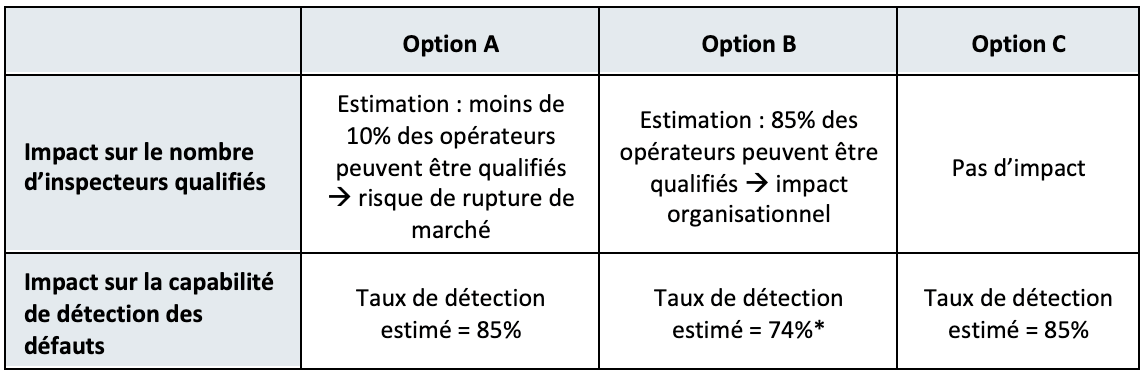
Bien que les résultats démontrent une probabilité de détection de ces défauts inférieure à 100%, un critère de qualification des défauts critiques est malgré tout imposé à 100%. Le site de production de produit pharmaceutique, malgré un entrainement renforcé de ses inspecteurs, est confronté à 3 options :
- Option A : Conserver l’ensemble des tailles de défauts présents dans le set d’habilitation dont la probabilité de détection (PoD) est supérieure à 70% et appliquer un critère de détection de 100%.
- Option B : Ne conserver que les tailles de défauts pour lesquelles la détection est proche de 100% dans le set d’habilitation et appliquer le critère de 100% de détection.
- Option C : Conserver l’ensemble des tailles de défauts présents dans le set d’habilitation dont la probabilité de détection (PoD) est supérieure à 70% et appliquer le critère de détection défini par l’étude de capabilité de détection (Knapp).
Les impacts sur le nombre d’opérateurs qualifiés et sur la capabilité de détection des défauts sont étudiés pour chacune des options :
- Le kit de qualification n’est plus représentatif des défauts naturels du procédé de fabrication et donc la performance du procédé démontré des qualifications n’est pas représentative de la performance réelle sur les lots délivrés sur le marché.
- Les opérateurs, n’étant plus challengés lors des qualifications avec les défauts critiques du procédé (car pas visibles à 100%) finissent par être désensibilisés des défauts réels du procédé de fabrication et ce lors de la phase d’inspection à 100% mais aussi de l’inspection des prélèvements pour NQA.
4. Conclusion
En somme, l’inspection visuelle doit être considérée comme probabiliste en raison des limites humaines et technologiques, de la variabilité du contenant et du produit, ainsi que des défauts générés lors de la fabrication du produit injectable, et ce quelle que soit la criticité des défauts.
Adopter une approche probabiliste de l’inspection visuelle, soutenue par des données statistiques pour établir et qualifier un processus d’inspection visuelle, est essentiel pour gérer les incertitudes et les variabilités inhérentes aux procédés de fabrication et d’inspection des produits pharmaceutiques injectables.
Cette approche est efficace, réaliste et durable pour maintenir des normes de qualité élevées dans la production de produits pharmaceutiques.
Elle garantit la qualité des produits tout en :
- Satisfaisant les attentes réglementaires qui reconnaissent les limitations des inspections humaines et automatisées actuelles.
- Assurant une méthode scientifiquement robuste, réalisable et précise du contrôle de la qualité et de la gestion des risques.
- Encourageant l’amélioration continue en fournissant des données sur les défauts et la performance des procédés de fabrication et d’inspection.
Exiger un taux de détection de 100% pour les défauts critiques, sans démonstration préalable par une étude statistique de la capacité d’inspection visuelle à atteindre réellement ce niveau (comme par exemple en suivant la méthode statistique Knapp), ignore les limites et variabilités fondamentales de l’inspection visuelle humaine.
Cela revient à établir des normes non fondées, non réalisables en pratique, et peut donc introduire des biais dans la gestion de la qualité du produit afin de pouvoir atteindre ce critère de qualification, augmentant ainsi les risques pour les patients.
Partager l’article
Les membres du GIC Inspection visuelle
USP <1>3
Each final container of all parenteral preparations should be inspected to the extent possible for the presence of observable foreign and particulate matter in its contents. The inspection process should be designed and qualified to ensure that every lot of all parenteral preparations is essentially free from visible particulates, as defined in Visible Particulates in Injections <790>. Qualification of the inspection process should be performed with reference to particulates in the visible range and those particulates that might emanate from the manufacturing or filling process.
USP <790>¹
All products intended for parenteral administration must be visually inspected for the presence of particulate matter as specified in Injections and Implanted Drug Products <1>. […] the term ‘essentially free’ means that when injectable drug products are inspected as described herein, no more than the specified number of units may be observed to contain visible particulates. Inspected units must be free of visible particulates when
examined without magnification against a black background and against a white background.
USP <1790>2
Although having zero defects is the goal and this should drive continuous process improvement, zero defects is not a feasible specification for visible particles given current packaging components, processing capability and the probabilistic nature of the inspection process. The visible particulate detection process is probabilistic: the
likelihood of detection is a cumulative function of visible attributes such as particle quantity, size, shape, color, density and reflectivity, as well as optical characteristics of the surrounding product and package. Understanding human performance is therefore critical to establishing visual inspection criteria[…] The probability of detection for all particles is dependent on the container characteristics (e.g. size, fill level,
shape and transparency), inspection conditions (lighting and duration), preparation characteristics (color and clarity) and particle characteristics (size, shape, color and density). Analysis of inspection results pooled from several studies conducted with standards prepared with single spherical particles shows that the probability of detection (PoD) for a seeded sample with a single 50μm particle in a clear […] is only slightly greater than 0%. The detection probability increases to approximately 40%–60% for a seeded standard with a 100μm particle, and the threshold for routine, reliable detection (≥70% PoD) of individual visible particles is often near 150μm in
diameter. Particles 200μm and larger are often necessary to achieve greater than 95% PoD. The PoD for fibers is often less than that discussed for similarly sized spherical particles above, with reliable detection often commencing at or above 500μm. Thus, in a qualified visual inspection system, the vast majority of non-fibrous particles that might go undetected and be introduced into the pharmaceutical supply chain will be smaller than 200μm across one of its planes (width, length, cross-section). Some injectable products are more difficult to inspect due to the nature of the primary container (e.g. increasing size, color and opacity), as well as dosage form characteristics (e.g. fill level; solution color, clarity or opalescence; and suspensions, lyophilized powders, emulsions and implants). Particle characteristics beyond size (e.g. color, shape and density) will also affect the PoD that can be achieved for a specific product and container system.
EP Parenteral Preparations
Liquid preparations for injection or infusion, if applicable after reconstitution, examined under suitable conditions of visibility, are practically free from visible particles.
EP 2.9.20
Particulate contamination consists of mobile undissolved substances, other than gas bubbles, unintentionally present in liquid preparations. The test is intended to provide a simple procedure for the visual assessment of the quality of liquid preparations, if applicable after reconstitution, as regards visible particles.
EP 5.17.2
Each container of a liquid preparation (e.g. vial, syringe,ampoule) is visually inspected after filling and closure.
During this 100% inspection, containers in which any particulates are observed are removed (culled) from the batchand rejected. The detection of visible particles is probabilistic by nature and depends on various factors such as: light intensity; inspection conditions; use and type of magnification; observation time; inspection background; distance from samples; type and speed of rotation; fill volume; primary packaging material, size and type; operator and equipment capability; and the size, number, type and refractive index of particles. Consequently, whilst the goal of a 100% inspection followed by acceptable quality level (AQL) testing is to eliminate all containers containing any visible particles, some of these may escape detection due to poor detectability and visibility. Every visual inspection system is therefore characterized by an accepted statistical probability to detect units with visible particles and an accepted statistical probability to miss units with visible particles.
JP General rules for preparations, 3 preparations for injection
Unless otherwise specified, injections and vehicles attached to preparations meet the requirements of Foreign Insoluble Matter Test for Injections <6.06>.
JP 6.06
Injections or vehicles must be free from readily detectable foreign insoluble matters when inspected against both a white and black background for 5 seconds each time with the unaided eyes at a position of light intensity of 2,000 to 3,750 lux under a white light source.
Chinese Pharmacopeia6
Validation shall be performed for relative equipment,and comparison evaluation of inspection efficiency shall be performed for automated inspection and manual inspection (for example Knapp-Kushner test), calibration
and check shall be performed prior to use.
ChP 0102 lnjections
Visible particles Unless otherwise specified, comply with the requirements of the Test for Visible Particles (0904).
ChP 0904 Test for Visible Particles
Visible particles are defined as insoluble substance that present in injections, ophthalmic liquid preparations or
sterilized drug substances and can be observed under the required conditions by visual test. Their sizes or lengths are usually more than 50 µm. Injections or ophthalmic liquid preparations should be produced according to the Good Manufacture Practice (GMP). All of the products should be detected respectively by suitable methods before release, and the unacceptable products are eliminated synchronously. It should not be used if the visible particles were found in the product by visual check under natural daylight (non-direct sunshine) before use.