Sommaire
- La vérification métrologique des compteurs de particules aériens : réaliser un banc de test qui permet de mesurer l'efficacité de comptage selon ISO 21501-4.
- De l'importance du suivi des paramètres de l'eau traitée entrante dans le producteur pour la fabrication des eaux à usage pharmaceutique.
- Nouvelles technologies pour la mesure de débit des procédés biopharmaceutiques à usage unique.
- L'étalonnage de sondes embarquées.
- Cleaning and disinfection - A one or a two steps process or scientifically justified ?
- Updated regulations on FDA acceptance of medical device clinical data in effect soon.
En ce qui concerne les paramètres physico-chimiques dans les eaux à usages pharmaceutiques, nous parlons très souvent du suivi analytique des boucles d’eau purifiée (EP) et d’eau pour préparations injectables (EPPI) avec des mesures en ligne de conductivité, d’ozone dissous, de COT mais moins souvent de la qualité de l’eau brute qui sert à cette production. Or l’eau qui entre dans l’usine doit déjà être considérée comme de l’eau à usage pharmaceutique.

Tout d’abord, la qualité de l’eau servant pour la production doit être conforme aux critères d’une eau potable, donc, soit délivrée par les services publiques ou délégataires compétents, soit, et c’est un cas fréquent, produite par le puisage dans le milieu naturel de surface (rivière…) ou aquifère (forage), dans la mesure où la qualité de cette eau brute soit conforme aux prérequis pour la consommation humaine (Cf. ARRETE DU 11 JANVIER 2007). Cet article ne parle pas des systèmes de traitement de l’eau brute, mais des principaux paramètres physico-chimique de l’eau traitée destinée à entrer dans le producteur.
1. Rappel sur le contexte réglementaire de l’eau à destination de consommation humaine
Le Ministère de la Santé français, en accord avec les directives européennes, fixe les normes applicables en France, pour le contrôle de la qualité de l’eau qui sera probabilisée.
Elles sont formalisées dans l’arrêté du 11 janvier 2007 relatif aux limites et références de qualité des eaux brutes et des eaux destinées à la consommation humaine.
Il faut savoir que toutes les eaux brutes ne sont pas utilisables pour produire de l’eau potable. Elles doivent respecter des critères et sont évaluées par 39 paramètres bactériologiques et physico-chimiques (dont les pesticides et les métaux lourds). Ainsi les eaux brutes doivent être traitées. L’objectif du traitement (même si ce n’est pas l’objet du présent article) est alors de protéger les consommateurs de micro-organismes pathogènes et d’impuretés désagréables ou dangereuses pour la santé. Une eau de surface nécessitera toujours un traitement complet physique et chimique alors qu’une eau souterraine ne pourra subir qu’un traitement chimique de désinfection, dès lors qu’elle ne connaît pas de contamination par le fer, le manganèse, l’arsenic, les nitrates et les produits phytosanitaires.
Pour terminer sur l’aspect réglementaire, ces arrêtés fixent, à la fois pour les eaux brutes et traitées, des limites de qualité au niveau microbiologique, physico-chimique, organoleptique (goût et odeur) et des paramètres indicateurs de la radioactivité. Selon l’EMA et la FDA, une fois le traitement réalisé, la qualité de l’eau pour produire de l’eau à usage pharmaceutique devra répondre aux critères d’une eau potable.
2. Le Suivi Analytique garant du pré-traitement
Aujourd’hui, il est facile de pouvoir suivre en continu des paramètres physico-chimiques clés qui permettront de garantir que la qualité de l’eau entrante ne se dégrade pas, et de fait, n’engendre pas de difficulté sur l’efficacité du producteur de l’eau à usage pharmaceutique (ultrafiltration, résine à lit mélangés, osmoseur multi passes, EDI, thermo compresseur etc…).
Les paramètres recommandés les plus simples à suivre sont les suivants bien que cette liste ne soit pas exhaustive :
- L’ammonium (NH4)
- Le Carbone Organique Total (COT)(1)
- Le pH et la température
- Le chlore libre et/ou chlore total
- La conductivité
- La turbidité
- La silice (SiO2)
2.1 L’ammonium (NH4)
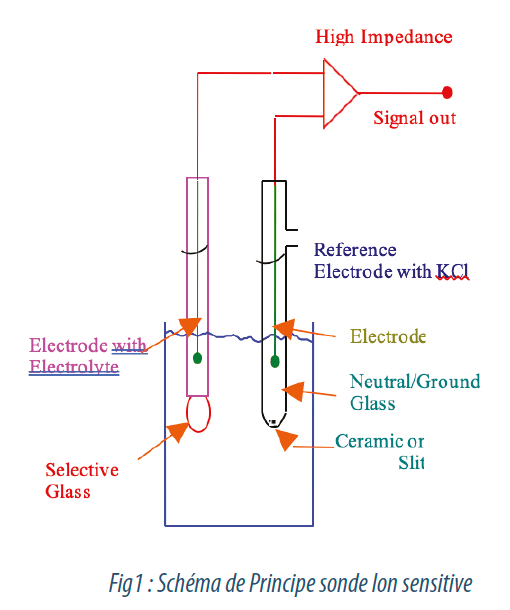 | Si l’ammonium est d’origine naturel, il ne faut cependant pas que l’eau en contienne plus de 0.1 mg/l. L’ammonium est tout simplement une source d’azote (de nutriment) pour les bactéries. De plus, dans le phénomène de nitratation (transformation de l’ammonium en nitrates), d’autres bactéries pratiquant la respiration anoxique se servent des nitrates comme source d’oxygène, dit lié, pour respirer. Cela aboutit à la formation de nitrites dont on connait les effets néfastes sur la santé. L’ammonium peut être suivi et contrôlé avec des analyseurs simples, par sonde sélective par exemple. Le principe est simple : l’échantillon passe dans une chambre d’analyse où sont plongées une sonde dite sélective à membrane, et une électrode de référence. Les ions ammonium passant dans la sonde de mesure à travers la membrane vont faire varier son potentiel par rapport à l’électrode de référence proportionnellement à leur concentration (Loi de Nernst). Le logiciel transforme et affiche le signal en mV sur le transmetteur directement en mg/l de NH4. |
2.2 Le Carbone Organique
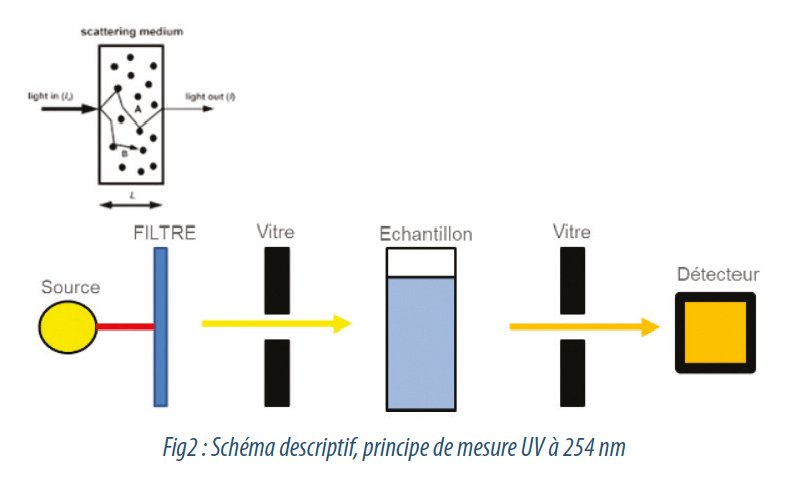
Très bien utilisé et très bien connu pour monitorer les contaminations organiques dans les boucles d’eau à usages pharmaceutiques, le COT est un élément très important à suivre dans l’eau “Brute” pour éviter d’apporter des sources de carbone en amont, et contaminer le producteur. S’il existe des analyseurs complexes très aboutis pour mesurer le COT par oxydation thermique et chimique, il existe aussi des méthodes très simples pour détecter une source de pollution organique en continu sur cette qualité d’eau, grâce à une mesure optique : la mesure d’absorption UV à 254 nm ou SAC 254. On parlera en unité d’absorbance, ou à l’inverse, de transmittance en %, ou l’absorption UV/unité distance (UV A : m-1, cm-1). Il s’agit de l’absorption de l’échantillon à une longueur d’onde de 254 nm sur une distance de cellule de mesure connue.
A cette longueur d’onde, la lumière absorbée par l’échantillon est directement proportionnelle aux molécules organiques dissoutes. Sur des matrices d’eau dont la composition est stable, il est même possible de faire des corrélations précises sur le COT, la DCO, en s’appuyant sur un réétalonnage de l’appareil après plusieurs mesures comparatives au laboratoire, en rentrant dans le logiciel les caractéristiques de pente et d’ordonnée à l’origine (pente et offset dans le langage commun des instrumentistes).
L’avantage de cette technologie (par rapport à l’oxydation thermique et/ou chimique) est qu’elle permet d’obtenir de bons résultats et qu’elle est bien plus économique puisqu’elle n’utilise pas de réactifs. Plus la valeur en m-1 ou cm-1 sera faible et moins l’eau sera chargée en organiques dissous et inversement. En revanche, cette technique ne peut pas être utilisée sur des eaux très chargées et ne suffira pas en termes de précision pour les eaux purifiées.
La référence de qualité pour ce paramètre est de 2 mg/l ou ppm (poids par million) de COT. Cette concentration ne devrait pas excéder 10 ppm en ce qui concerne l’eau brute puisée dans le milieu naturel.
 |  |
2.3 Le pH et la température
Le pH reste un critère de qualité, car l’eau ne doit pas être trop acide ou trop basique, c’est-à-dire, ni corrosive ni incrustante. Le pH est toujours mesuré avec la température, car il varie avec elle. Pour que tout le monde parle le même langage, la valeur est très souvent ramenée à 25°C (On parle de compensation).
Sur les analyseurs de pH, il y a donc toujours une sonde de température, soit séparée, soit combinée. Le principe de mesure du pH repose sur le même principe que la mesure d’ammonium, sauf qu’ici, l’électrode en verre est sélective aux ions H+ faisant varier le potentiel Redox de celle-ci par rapport à la référence. Selon la loi pH = -log [H3O+], le logiciel transforme et affiche le pH, par une valeur comprise en 0 et 14. Une solution est dite acide lorsque le pH est inférieur à 7, basique lorsqu’elle est supérieur à 7 et neutre lorsque le pH est égale à 7.
2.4 Le chlore libre et total
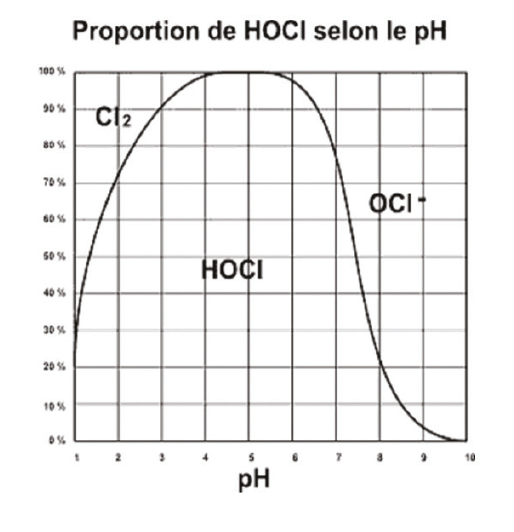 | Le chlore est l’agent désinfectant le plus utilisé que l’on ajoute dans l’eau. De fait l’eau potable doit être désinfectée et désinfectante (elle doit toujours contenir un résiduel de chlore actif résiduel). Le chlore, sous sa forme active “acide hypochloreux” est un agent de désinfection puissant possédant des propriétés rémanentes, c’est-à-dire, qu’il continuera d’agir partiellement même après l’arrêt de son adjonction (pas indéfiniment, si on stoppe son injection). Le chlore se décompose dans l’eau en fonction du pH, et sa forme désinfectante “chlore actif” prédomine à des valeurs de pH précises : entre 4 et 7,5. Le chlore “libre”, est en fait la forme de ces 3 espèces chimiques, gazeux, HCLO et ClO. |
 |  |
Cas spécifique du chlore :
Le chlore actif va se combiner sur l’ammoniac pour former ce qu’on appelle le chlore combiné (ou chloramines). On distingue les mono, di et tri-chloramines, qui se forment en chaine jusqu’à leur dégazage sous forme de trichloramines si l’on pousse le dosage du chlore au “break point”(2). Pour résumer, tout le chlore ajouté après cette dose reste sous forme chlore libre résiduel, en eau potable, le chlore libre résiduel doit être de 0.1 ppm au point de livraison.
Ce chlore combiné est responsable pour partie, du goût et de l’odeur de l’eau. On comprend pourquoi il faut donc une faible quantité d’ammonium à la base dans une eau, pour limiter l’apport en chlore. Effectivement, le chlore libre sera consommé et devra toujours être en quantité suffisante pour assurer la désinfection, donc il devra être surveillé, voire régulé.
Et c’est donc toutes ces formes du chlore (libre et combinées) qui composent le chlore total, et il est compréhensible qu’une diminution du chlore libre et une augmentation du chlore total induira une pollution à l’ammoniac.
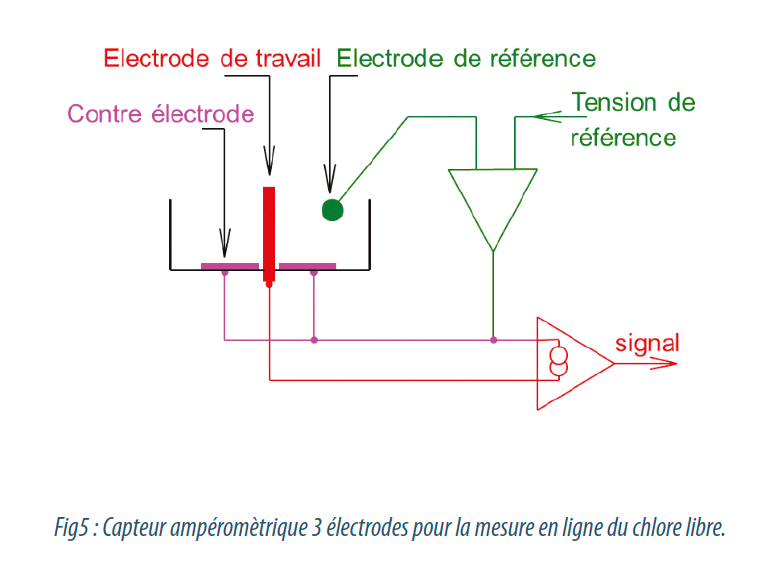
Le chlore total se mesure par différentes méthodes, mais la méthode la plus sûre est la plus fiable est la méthode normalisée de référence à la DPD (DIN EN ISO7393-2 et APHA 4500-CI G). L’ajout de DPD, en milieu tamponné, et en présence de iodure de potassium, après une réaction de 2 minutes, révèle le chlore total sous la forme d’un complexe rose, dont l’intensité est directement proportionnelle à sa concentration. Cette intensité est lue avec un spectro-photomètre à une longueur d’onde autour de 515 nm.
Dans la pratique, l’analyseur ci-contre réalise cette mesure : l’ajout des réactifs liquides se fait dans une chambre ou passe l’échantillon, puis il est stocké pendant 2 minutes par une électrovanne avant lecture dans le photomètre, puis évacuation et rinçage, jusqu’au prochain cycle.
NB : le chlore sera éliminé par voie chimique (bisulfite de sodium) ou physique (charbon actif) car il ne faudra pas endommager les résines ou les membranes filtrantes en aval, très sensibles au chlore et chloramines. La mesure d’absence de chlore total est primordiale en amont de ces procédés.
Seule la méthode colorimétrique apporte satisfaction pour ce rôle, car elle n’est pas soumise au phénomène de dépolarisation (contrairement aux capteurs ampérométriques).
2.5 Conductivité
Il s’agit d’un indicateur, non spécifique, de pollution minérale (les ions) qui se traduit par la capacité de l’eau à conduire un courant électrique. La mesure de conductivité est liée à la loi d’Ohm : U = R x I, U étant la tension en volts, R la résistance en ohms et I le courant en ampères.
La conductivité C, exprimée en Siemens par centimètre est le résultat de l’équation suivante :
C = k x G, où G est l’inverse de la résistance exprimé en Siemens et k, une constante exprimée en cm-1.
Cette constante k est une valeur liée à la constitution de l’électrode de mesure : c’est le rapport entre la distance séparant les électrodes et leur surface :
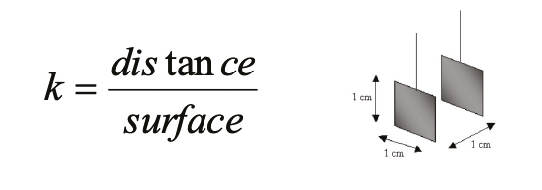 | La conductivité d’une solution dépend de :
Ainsi, la conductivité, associée à la température traduit l’état de la minéralisation totale d’une eau. |
Dans la pratique, pour la mesure en ligne, les fabricants ont développé des capteurs constitués le plus souvent de 2 ou 4 électrodes en matériaux nobles (acier inoxydable 316, titane, platine) selon le principe vu précédemment. Une tension est appliquée aux électrodes en contact avec la solution à analyser. La conductance permet de calculer la conductivité, la concentration ou la résistance spécifique de la solution.
La référence qualité pour l’eau entrante dans l’usine: la conductivité doit être comprise entre 200 et 1100 µS/cm à 25 °C.
2.6 La turbidité
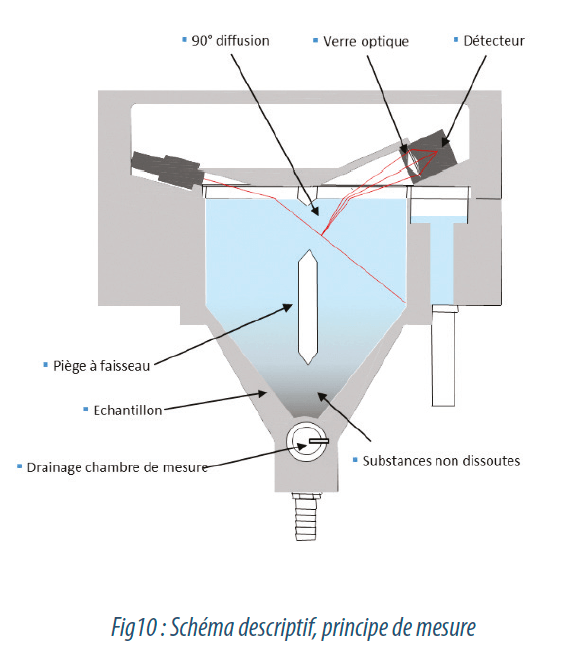 | La turbidité définit l’aspect trouble de l’eau. Les éléments responsables sont en fait des colloïdes issus de la décomposition humique des végétaux et animaux, qui sont des particules de l’ordre du micron chargées électro-négativement et qui ne décantent pas, du fait qu’elles se repoussent sans arrêt. Les colloïdes sont un support de développement bactérien, et c’est pour cela que plus la turbidité sera basse, plus la qualité de l’eau sera bonne pour ce paramètre. On parle communément d’une eau limpide. La mesure de turbidité est réalisée par technologie optique, selon une norme avec laquelle tous les fabricants se sont accordés, afin que tout le monde présente un résultat sur la base du même référentiel. Il s’agit de la norme ISO 7027. Un faisceau lumineux (lumière blanche (USA), infrarouge LED (Europe)) est émis à travers l’échantillon contenant des colloïdes, les phénomènes de diffraction, de réfraction et de diffusion font leur office. C’est pour cela que seule la lumière transmise sur un angle de 90° au récepteur photosensible permet de calculer la turbidité, finalement traduite par la différence entre l’intensité de lumière émise et celle perçue. Le résultat est affiché en NTU pour NEPHELOMETRIC TURBIDITY UNIT. Il existe des analyseurs dits traditionnels, ou le faisceau traverse d’abord une paroi de verre avant l’échantillon, ce qui implique de l’encrassement, et une nécessité de nettoyage régulier (essuie-glace/ retro lavage/ultra-sons…) pour éviter la dérive de la mesure. |
Aujourd’hui, il existe des appareils dits “sans contact”, qui garantissent une mesure sans dérive et sans consommable, car l’eau n’est jamais en contact avec les optiques de mesure, et rien ne se positionne entre elles et l’échantillon, hormis le contact de l’air. La turbidité serait ici un bon indicateur de protection des membranes d’osmose, bien qu’il ne remplace pas l’indice de colmatage. La limite de qualité pour notre sujet est de 1 NTU, bien que la référence qualité serait de 0.5 NTU. (Sachant que l’on autorise pour l’eau potable au robinet 2 NTU).
2.7 La silice
Bien qu’il n’y soit pas clairement de normalisation sur la silice, il est pourtant ici un paramètre extrêmement important selon la nature du producteur. La silice est présente naturellement dans l’eau, sous différentes formes, la silice ionisée : SiO2-, la silice colloïdale, les silicates complexes (combinaison avec le fer, l’aluminium, le magnésium, le potassium…) Toutes ces formes sont exprimées en SiO2-.
Comme la solubilité de la silice diminue avec l’augmentation de la pression et de la température, on comprend qu’il est essentiel de maintenir le taux de silice le plus bas possible à l’entrée de certains producteurs et notamment de distillateurs, qui peuvent se trouver vitrifié par la silice et perdre complètement leur efficacité.
La silice se détermine par analyse spectrophotométrique, au même titre que le chlore, la silice dissoute est mesurée ici au bleu de molybdate à une longueur d’onde 810 nm. L’intensité de cette coloration sera proportionnelle à la concentration en silice dissoute.
 | Cette réaction complexe s’effectue en plusieurs temps dans la chambre photométrique : – Réaction de la silice et des ortho-phosphates avec le molybdate d’ammonium (1) en milieu acide (2) (couleur jaune). Les valeurs cible devraient se situer aux alentours des 20 ppb (20µg/l). |
2.8 Métrologie appliquée à ce type de capteur (Cf. glossaire pour les définitions)
Bien que ce ne soit pas le sujet du présent article, nous pouvons toutefois indiquer que ces analyseurs devront évidement être suivis pour s’assurer de leur bon fonctionnement et acceptable et qu’ils produisent des résultats fiables.
En ce qui concerne les technologies capteurs, comme les sondes ISE ammonium ou pH nécessiteront un contrôle hebdomadaire dans une ou plusieurs solutions standard étalons. D’un point de vue métrologique, on parle de vérification ou d’étalonnage. Si l’écart est supérieur à 10 %, il est recommandé de procéder à un ajustement, c’est-à-dire modifier les paramètres de capteurs de pente et d’offset, afin de lui permettre d’atteindre les performances pour lesquelles il est fait.
Pour les capteurs de conductivité, plus stables dans le temps, Une vérification mensuelle par sonde étalon ou appareil certifié de terrain sera suffisante, avec, un ajustement si besoin.
Les technologies optiques sont reconnues pour être stables et ne pas dériver, et les critères métrologiques sont un peu différents, car il n’existe pas toujours de solution standard étalon stable (cas du chlore, ou de l’ozone par exemple).
Il est cependant possible de contrôler les systèmes avec des solutions standards étalons lorsqu’elles existent, ou alors, et selon les normes du NIST de vérification des spectrophotomètres, nous pouvons utiliser des filtres ou des cristaux étalons, rattachés aux standards nationaux, afin de vérifier les dérives des systèmes optiques.
Enfin, il est toujours possible de mesurer avec des appareils analogues de terrain, appelés étalons secondaires rattachés aux standards nationaux et donc certifiés, pour étalonner et ajuster au besoin les appareils de mesures contrôlés.
Pour conclure, cet article a été rédigé pour que les gestionnaires des outils de production prennent conscience de l’importante de la qualité de l’eau en amont du producteur. L’ajout d’automates physico-chimiques sur certains points stratégiques de l’usine permettra encore d’améliorer le suivi et la disponibilité de l’outil de production et d’être plus réactif en cas de dérive, et ce bien en amont de la boucle d’eau et de l’utilisateur. On imagine très bien les conséquences d’une eau brute contaminée, via des canalisations ayant des biofilms, par manque de chlore par exemple. Elle pourrait être à l’origine d’une contamination du producteur… On constate donc l’importance de contrôler la présence de chlore à l’entrée de l’usine , bien que ce chlore doit être éliminé par la suite pour le bon fonctionnement du process : les conséquences pourraient être assez dramatiques pour des pré-traitements membranaires ou résines très sensibles aux oxydants, ou au colmatage. C’est pourquoi il est très important de suivre en amont d’un osmoseur l’absence de chlore total, pour s’assurer du bon fonctionnement du charbon actif ou de l’injection de bisulfite. De plus, suivre la turbidité permet d’avoir une image de ce qui peut contribuer au colmatage des membranes.
Il s’agit donc clairement de bénéficier d’une traçabilité, d’accroitre la réactivité en cas de dérive sur l’eau entrante, pour mettre en place des actions correctives au plus tôt. Cela permettra d’éviter :
- des dépenses coûteuses en curatif (résines, membranes d’osmose, temps d’intervention…),
- les coûts associés en cas d’arrêt de la production,
- les justifications et la production de documents associés.
Sur un aspect métrologique, il ne faudra pas oublier que ces analyseurs doivent être suivis et étalonnés si besoin.
Les paramètres cités ne sont pas exhaustifs, mais constituent une très bonne base pour atteindre de bonnes performances.
Partager l’article

Benjamin GRACIA – SWAN
benjamin.gracia@swan-france.fr

Guillaume SCHNEIDER – SWAN
guillaume.schneider@swan-france.fr
Glossaire
EMA : European Medicines Agency
FDA : Food and Drug Agency
Bibliographie
Dernier arreté du 11 janvier 2007 relatif aux limites et références de qualités des eaux brutes et destines à la consommation humaine.
Documents internes swan.
Définitions
Carbone Organique Total Il s’agit des formes du carbone présent dans l’eau, elles peuvent être sous forme dissoutes ou non. Il s’agit d’un critère de pollution dit organique. Le carbone peut être issus de la décomposition des animaux et végétaux, et c’est aussi une source de carbone pour les bactéries, qui peuvent donc se développer.
Break Point Il s’agit de la méthode utilisé pour l’élimination des chloramines dans l’eau (responsable du goût et de l’odeur). Les chloramines se forment par l’action du chlore sur l’ammoniac, qui est aussi présent dans la matière organique, sous forme d’urée par exemple. Pour une eau potable lambda, on réalise le test en laboratoire suivant, pour s’assurer que le dosage du chlore sera suffisant pour maintenir un résiduel de chlore libre au point de livraison. Cela consiste à injecter du chlore dans l’échantillon d’eau, et de faire des mesures régulières de chlore libre en fonction du temps. Dans un premier temps, le chlore actif est consommé pour former en chaine les mono, di et tri-chloramines (gazeuses), enfin, au bout d’un certain temps, tout le chlore ajouté est mesuré en chlore libre, car il n’y a plus d’ammoniac pour la réaction. Le point d’inflexion de la courbe est appelé “Break Point”.
Norme ISO en 7393-2 – pour la mesure du chlore Intitulé Qualité de l’eau – Dosage du chlore libre et du chlore total – Partie 2 : méthode colorimétrique à la N,N-diéthylphénylène-1,4 diamine destinée aux contrôles de routine .
Le présent document spécifie une méthode de dosage du chlore libre et du chlore total dans l’eau, aisément applicable dans le cadre d’essais en laboratoire et sur le terrain. Elle est basée sur le mesurage de l’absorption du composé DPD rouge dans un photomètre ou sur le mesurage de l’intensité de la couleur par comparaison visuelle de la couleur avec une échelle d’étalons régulièrement calibrée. Cette méthode convient pour l’eau potable et d’autres eaux, où des halogènes supplémentaires comme le brome et l’iode, et d’autres agents oxydants sont présents dans des quantités presque négligeables. L’eau de mer et les eaux contenant des bromures et des iodures constituent un groupe nécessitant la mise en oeuvre de procédés particuliers. Cette méthode est applicable dans la pratique à des concentrations, en termes de chlore (Cl2) , comprises par exemple entre 0,000 4 mmol/l et 0,07 mmol/l (c’est-à-dire entre 0,03 mg/l et 5 mg/l) pour le chlore total. A plus forte concentration, la prise d’essai est diluée. En général, la méthode est appliquée en tant que méthode de terrain avec des photomètres mobiles et des réactifs prêts à l’emploi disponibles dans le commerce (réactifs liquides, poudres et tablettes) . Il est essentiel que ces réactifs satisfassent aux exigences minimales, et qu’ils comportent les réactifs essentiels et un système tampon permettant d’ajuster le pH de la solution de mesure sur une gamme généralement comprise entre 6,2 et 6,5. En cas de doute concernant les valeurs de pH et/ou les pouvoirs tampon inhabituels que pourraient présenter les échantillons d’eau, l’utilisateur doit contrôler et, si nécessaire, ajuster le pH de l’échantillon à la gamme requise. Le pH de l’échantillon doit être compris entre 4 et 8. Procéder, si nécessaire, à un ajustement au moyen d’acide sulfurique ou d’une solution d’hydroxyde de sodium avant l’essai. Une méthode permettant la différenciation du chlore combiné de type monochloramine, du chlore combiné de type dichloramine et du chlore combiné sous forme de trichlorure d’azote est présentée à l’Annexe A. L’Annexe C présente quant à elle un mode opératoire pour le dosage du chlore libre et du chlore total dans les eaux de boisson et les autres types d’eau faiblement polluée, avec des cuves planes à usage unique remplies de réactif, utilisées avec une pompe ou un colorimètre à canal mésofluidique.
Source : AFNOR APHA 4500-CI G : équivalent normes américaines pour le chlore (= ISO EN 7393-2)
Turbidité L’ISO 7027-1 :2016 prescrit deux méthodes quantitatives de détermination de la turbidité de l’eau, à l’aide de turbidimètres ou de néphélomètres optiques:
a)la néphélométrie, qui est une méthode par mesurage du rayonnement diffus, applicable aux eaux de faible turbidité (par exemple, les eaux de boisson);
b) la turbidimétrie, qui est une méthode par mesurage de l’atténuation du rayonnement, plus appropriée aux eaux de forte turbidité (par exemple, eaux résiduaires ou autres eaux troubles).
Les turbidités mesurées suivant la première méthode sont exprimées en unités de turbidité néphélométriques (NTU). Elles sont généralement comprises entre 0,05 NTU et 400 NTU. Selon les caractéristiques de l’appareillage, cette méthode peut être également utilisée pour des eaux de plus forte turbidité. Il existe une équivalence numérique entre les unités de turbidité néphélométriques (NTU) et les unités néphélométriques formazine (FNU). La turbidité mesurée selon la seconde méthode est exprimée en unités d’atténuation formazine (FAU), elle est généralement comprise entre 40 FAU et 4000 FAU. Source : Organisation Internationale de Normalisation
ISE Ion Sensitive Electrode : sonde de mesure d’un capteur sélectif à un élément donné, comme sonde Ammonium, ou sonde de mesure de pH par exemple.
Etalon C’est une référence, avec une valeur et une incertitude, à laquelle on se compare pour établir la justesse et la traçabilité de ses résultats. Plus l’incertitude de l’étalon est faible, meilleure est sa qualité. On va de l’étalon de travail (grande incertitude) à l’étalon primaire (très faible incertitude).
Source : LNE (Laboratoire National d’Essais, internet)
Etalonnage C’est la comparaison des valeurs d’un instrument de mesure à celles d’un étalon, en associant les incertitudes. Cette comparaison permet d’estimer le biais (la justesse) de l’instrument. Les valeurs obtenues par un étalonnage sont consignées dans un “certificat d’étalonnage”. Un étalonnage peut être réalisé à plusieurs points de l’étendue de mesure de l’équipement à étalonner. On obtient ainsi une courbe d’étalonnage.
Source : LNE, internet
Ajustement ou ajustage Ensemble d’opérations réalisées sur un système de mesure pour qu’il fournisse des indications prescrites correspondant à des valeurs données des grandeurs à mesurer. NOTE 1 Divers types d’ajustage d’un système de mesure sont le réglage de zéro, le réglage de décalage, le réglage d’étendue (appelé aussi réglage de gain).
NOTE 2 Il convient de ne pas confondre l’ajustage d’un système de mesure avec son étalonnage, qui est un préalable à l’ajustage.
NOTE 3 Après un ajustage d’un système de mesure, le système demande généralement à être réétalonné.
Source : Vocabulaire international de la métrologie, internet
NIST Le National Institute of Standards and Technology ou NIST (qu’on pourrait traduire par “Institut national des normes et de la technologie”), est une agence du département du Commerce des États-Unis.
Source : internet











