Sommaire
- Les méthodes rapides en microbiologie. Une opportunité pour tout un chacun au sein de l’entreprise.
- Libération des lots de produits injectables : une affaire d’état !
- Cahier Pratique – Rationalisation des qualifications périodiques des autoclaves, des tunnels de dépyrogénation et des laveuses de flacons pour les formes injectables
- La détection des mycoplasmes par qPCR : les challenges de la mise en place de ce test en remplacement de la méthode réglementaire par culture décrite dans différentes pharmacopées (USP, EP, JP…)
- Environmental Monitoring Program: Hot topics in Microbiology & Best Practices.
- Quel est l’impact des désinfectants sur les contrôles d’environnement ?
- Current U.S.P. Perspectives on Microbial Identification
Le programme de contrôle de l’environnement est l’un des éléments indispensable de la maîtrise de la qualité des environnements des productions pharmaceutiques, il est donc essentiel d’employer des solutions de suivi capables de détecter toute dérive pouvant entrainer la perte de cette maîtrise.
Concrètement le contrôle de l’environnement repose majoritairement sur l’utilisation de milieux de culture gélosés qui doivent permettre de recouvrer chaque éventuel microorganisme vivant mais également neutraliser la présence de résidus de désinfectants pouvant inhiber la croissance de certaines souches tout en favorisant une pousse suffisante pour être vue par un opérateur.
De la performance de ces milieux dépend la qualité des résultats des contrôles et bien évidemment de la pertinence des analyses de tendance qui en découlent. Mais valider des milieux de culture pouvant récupérer les germes stressés de l’environnement dans une salle propre n’est pas une chose si aisée ! Pour mieux comprendre l’interaction entre milieux de culture et désinfectants dédiés au contrôle de l’environnement nous avons étudié les propriétés des biocides les plus communément utilisés dans l’industrie pharmaceutique et proposé une méthodologie pour évaluer leur impact sur la performance de ces milieux.
La fabrication des médicaments dans un environnement aseptique reste une tâche complexe. Le maintien de la qualité des zones de production passe par le respect de nombreuses procédures dont celles relatives au nettoyage et à la décontamination et bien évidemment par l’emploi de différents biocides. Le choix du bon désinfectant s’avère donc crucial pour garantir la bonne maîtrise de la biocharge. Tout cela est nécessaire mais n’est cependant pas suffisant. Il reste ensuite à s’assurer du niveau de propreté des surfaces et pour réaliser ce travail, l’emploi de milieux de cultures gélosés est largement répandu dans le monde des industriels de la pharmacie. Ces milieux, généralement au format de géloses contact, sont chargés de faire croitre les potentiels microorganismes présents et évaluer la contamination des surfaces. Ils vont être confrontés directement à ces désinfectants. Mais comment estimer la compatibilité entre désinfectant et milieu de culture sans pour cela faire de lourdes validations ?
Commençons par nous intéresser aux différentes biocides utilisés dans l’industrie pharmaceutique.
| Chemical Entity | Classification | Example | ||
| Aldehydes | Sporicidal agent | 2% Glutaraldehyde | ||
| Alcohols | General purpose disinfectant, antiseptic, antiviral agent | 70% Isopropyl alcohol, 70% alcohol | ||
| Chlorine and sodium hypochlorite | Sporicidal agent | 0.5% Sodium hypochlorite | ||
| Phenolics | General purpose disinfectant | 500 μg per g Chlorocresol, 500 μg per g chloroxylenol | ||
| Ozone | Sporicidal agent | 8% Gas by weight | ||
| Hydrogen peroxide | Vapor phase sterilant, liquid sporicidal agent, antiseptic | 4 μg per g H2O2 vapor, 10%–25% solution, 3% solution | ||
| Substituted diguanides | Antiseptic agent | 0.5% Chlorhexidine gluconate | ||
| Peracetic acid | Liquid sterilant, vapor phase sterilant | 0.2% Peracetic acid, 1 μg per g peracetic acid | ||
| Ethylene oxide | Vapor-phase sterilant | 600 μg per g Ethylene oxide | ||
| Quaternary ammonium compounds | General purpose disinfectant, antiseptic | 200 μg per g Benzalkonium chloride | ||
| ß-Propiolactone | Sporicidal agent | 100 μg per g – . Propiolactone |
General Classification of Antiseptics, Disinfectants, and Sporicidal Agents – U.S.P. <1072> Disinfectants and antiseptics
Le choix des désinfectants est une tâche complexe. Il existe différents textes qui peuvent guider les industriels dans leurs choix. L’U.S.P. <1072>1 propose une classification intéressante des molécules ayant des propriétés antimicrobiennes en indiquant la ou les cibles visées et donne des exemples de concentrations effectives.
L’ASTM (2) oriente également les industriels de la pharmacie vers la sélection d’un ou deux désinfectants et d’un sporicide mais surtout vers l’utilisation de formulations incorporant plus d’un type d’agents chimiques pour ainsi obtenir le meilleur équilibre entre la performance de désinfection et une agression limitée des surfaces à traiter. L’ASTM souligne que les produits utilisés dans les désinfectants ayant des spectres d’activité pouvant varier, les mélanges permettent ainsi de garantir une efficacité la plus large possible. Par voie de conséquence, la majorité des désinfectants présents sur le marché est un mélange de plusieurs molécules actives.
Nous voyons que trouver le bon produit n’est pas une chose simple et à cette difficulté vient s’ajouter la nouvelle directive européenne REACH qui va grandement limiter l’introduction de nouvelles molécules, voire de remettre en question l’emploi de certaines d’entre elles comme les biguanides par exemple.
Il faut donc envisager une complexification croissante des formulations désinfectantes et bien évidemment un challenge de neutralisation accru pour les milieux de culture.
Quel est l’impact des désinfectants sur le contrôle d’environnement ?
Les fournisseurs de biocides proposent une grande variété de formulations avec les différents agents précédemment cités. Mais en fonction de la famille du composé chimique ou de sa concentration lors de son utilisation, la quantité résiduelle de ces produits peut fortement varier. On peut classifier les composés chimiques en 2 grandes catégories : les composés qui laissent des résidus et ceux qui n’en laissent pas.
| PROPRIETE | |||
| DESINFECTANT | Irritation | Corrosif | Résidus |
| Alcool | Moyen | Faible | Non |
| Aldhéhydes | Très élevé | Elevé | Oui |
| Surfactants amphotères | Faible | Faible | Oui |
| Biguanide | Faible | Faible | Oui |
| Hypochlorites | Elevé | Elevé | Oui |
| H2O2 / Acide peracétique | Elevé | Moyen | Non |
| Composés phénols | Elevé | Moyen | Oui |
| Amonium quaternaires | Faible | Faible | Oui |
Source: Shield Medicare – Cleanroom Technology 10/2005
Pour élaborer notre modèle, nous avons sélectionné différents désinfectants communément utilisés par l’industrie pharmaceutique et, en se basant sur leur formulation, réalisé un classement sur leur propension à laisser des résidus sur les surfaces.
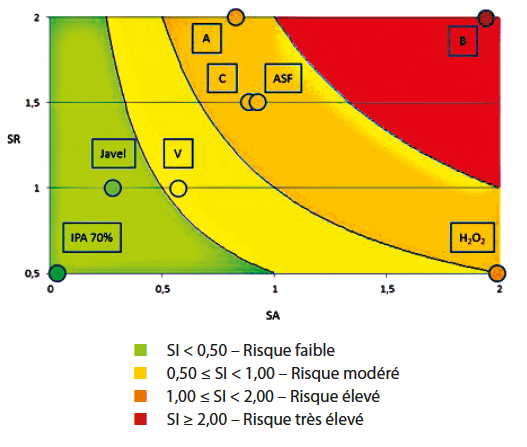
Quatre catégories de scores de résidus (SR) ont été créées en fonction de la probabilité que le désinfectant laisse des résidus sur les surfaces (de SR = 0,5 faible jusqu’à SR = 2 très élevé, voir tableau).
Nous avons ensuite évalué leur performance antimicrobienne sur un panel de microorganismes varié intégrant 3 souches de la Pharmacopée (Pseudomonas aeruginosa ATCC 9027, Bacillus subtilis ATCC 6633, Staphylococcus aureus ATCC 6538) et 4 souches sensibles issues d’isolats de salles blanches de l’industrie pharmaceutique (Staphylococcus epidermidis, Bacillus pumilus, Corynebacterium striatum, Penicillium commune). Pour cela, un volume de 500 μl de désinfectant (à la concentration retenue) a été déposé sur des géloses standard sans neutralisant. Après séchage, ces milieux ont été inoculés avec les souches du panel à une concentration entre 10 et 100 U.F.C. et les milieux incubés. Les taux de recouvrement sont finalement calculés.
| Désinfectants prêt à l’emploi | Score de résidus (SR) | Concentration retenue |
| A | Très élevé (2) | Pur |
| B | Très élevé (2) | 1/10 |
| ASF | Elevé (1,5) | Pur |
| C | Elevé (1,5) | Pur |
| V | Moyenne (1) | Pur |
| Javel | Moyenne (1) | Pur |
| Peroxyde d’hydrogène | Faible (0,5) | 1/10 |
| Alcool isopropylique 70% | Faible (0,5) | Pur |
La concentration retenue représente la concentration permettant de récupérer au minimum une faible pousse sur au moins une souche du panel.
A partir des taux obtenus pour toutes les souches, un premier score sur la performance antimicrobienne (SA) peut être donné.
SA = 1 – (Moyenne des taux de recouvrement du panel)
si la concentration retenue est pure
SA = 2 – (Moyenne des taux de recouvrement du panel)
si la concentration retenue est 1/10
SA est une valeur comprise entre 0 et 2.
Le score final de l’impact du désinfectant (SI) sur le milieu est alors calculé en multipliant SR et SA. Ce score d’impact est une estimation du risque que représente un désinfectant en termes de neutralisation et donc d’induire des mauvais taux de récupération des microorganismes de l’environnement et une analyse de tendance non représentative de la réalité.
| Désinfectants | SA | SR | SI |
| A | 0,88 | 2 | 1,76 |
| B | 1,87 | 2 | 3,74 |
| ASF | 0,95 | 1,5 | 1,43 |
| C | 0,90 | 1,5 | 1,35 |
| V | 0,58 | 1 | 0,58 |
| Javel | 0,24 | 1 | 0,24 |
| Peroxyde d’hydrogène | 1,99 | 0,5 | 1,00 |
| Alcool isopropylique 70% | 0,03 | 0,5 | 0,02 |
Une représentation graphique de SI permet de visualiser rapidement l’impact potentiel du désinfectant sur la performance de croissance d’un milieu de culture.
Il est intéressant de noter que l’alcool isopropylique ressort comme un désinfectant qui ne présentera pas un impact majeur. A contrario, le désinfectant B devra faire l’objet d’une évaluation sérieuse avec les neutralisants présents dans la gélose utilisée pour le contrôle de l’environnement. En effet le risque d’avoir une forte concentration de résidus avec un fort pouvoir antimicrobien est très élevé, le pouvoir de neutralisation du milieu de culture utilisé devra donc être adapté à ces niveaux pour permettre le développement des potentiels microorganismes encore viables mais inhibés par ces résidus.
Les résultats pour le peroxyde d’hydrogène et le désinfectant A démontrent qu’il n’y a pas de corrélation entre la quantité de résidus et le risque sur le milieu de culture puisque 4 désinfectants ayant pourtant des niveaux résiduels très différents se retrouvent tous dans la catégorie de risque élevé. L’H2O2 restant le composé testé dans le panel ayant le plus fort pouvoir antimicrobien mais qui présente aussi le moins de résidus.
Discussion
Le contrôle de la biocontamination des salles propres passe par la validation des désinfectants puis des milieux de culture. De la connaissance des interactions et de la validation de leur compatibilité entre ces deux produits dépendent les résultats des contrôles d’environnement. Cependant il n’existe pas de guide de concordance entre les fournisseurs de biocide et de milieux de culture. Nous avons alors cherché à élaborer un modèle simple pour mesurer, au-delà de la performance de désinfection, l’impact des formules désinfectantes sur les milieux de culture. Ce modèle ne remplace pas une validation mais est un outil de mesure efficace des risques.
Cette méthodologie peut permettre également une aide dans le choix des milieux de culture qui devront être employés. Différentes formules de milieux de culture sont disponibles sur le marché avec des niveaux de neutralisation variables. Certaines géloses sont proposées avec 2 neutralisants (lécithine et polysorbate 80) ou bien 4 (lécithine, thiosulfate, histidine et polysorbate 80) et il existe également des nouvelles gammes de géloses avec des neutralisants renforcés.
L’application de la méthodologie peut permettre une première orientation sur la performance de neutralisation attendue en fonction de l’échelle de risque du désinfectant. Aujourd’hui, la plupart des formulations proposées par les fournisseurs de milieux incluent 4 neutralisants, ce qui semble correspondre à la majorité des besoins de neutralisation.
Cependant nous voyons que les nouveaux biocides proposent des formulations de plus en plus complexes et comme pour l’exemple du désinfectant B, ils représentent un risque plus élevé de mauvaise neutralisation.
En conséquence, la recherche de milieux à plus large spectre de neutralisation deviendra inévitable pour assurer des résultats de contrôles d’environnements pertinents.

Laurent LEBLANC – BIOMÉRIEUX
laurent.leblanc@biomerieux.com
Partager l’article
Glossaire
ASTM : American Society for Testing and Materials
IPA : Alcool isopropylique
REACH : Registration, Evaluation and Authorisation of Chemicals
USP : United States Pharmacopoeia