Sommaire
- Du Capteur au Serveur pour valider, produire, piloter, libérer… Les enjeux de l’évolution de l’automatisation du procédé à son pilotage par ses données
- Profiter de l’extension de la capacité de production pour établir de nouveaux standards en Automatisation de Procédés
- Cahier Pratique – Évaluation des fournisseurs en SI (Systèmes Informatisés)
- Du design à la production Retour d’expérience du point de vue engineering (La Vague 50)
- Extension, Revamping et Mutualisation de Systèmes de Contrôle Informatisés
- BioCloud4.0 A patient-centric global IT solution of the new generation, designed for biotech organizations
- Difficultés du management des SI sur un site pharmaceutique
L’objet de cet article est de mettre en avant la mobilisation de plus en plus importante et élaborée des ressources informatiques pour la production pharmaceutique.

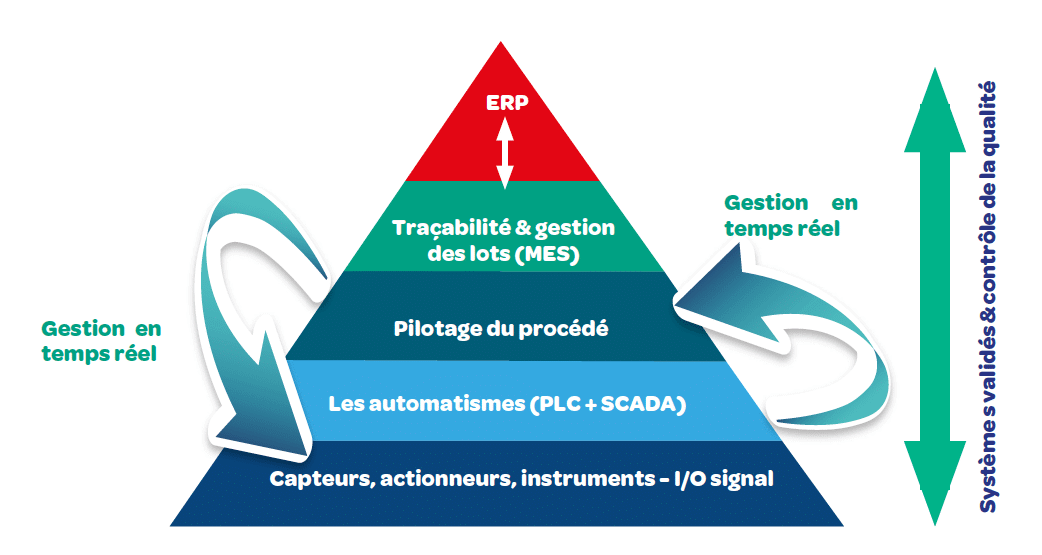
Historiquement, la production pharmaceutique est passée d’une production artisanale (issue du travail en laboratoire) caractérisée par un process essentiellement manuel vers une production automatisée basée sur la mesure et le contrôle/commande automatisé des équipements et organes de pilotage.
Aujourd’hui, les systèmes automatisés/informatisés permettent de réaliser le pilotage du processus, de collecter les informations sur son déroulement et d’en réaliser le contrôle qualité, tout cela en temps réel.
Le développement industriel en pharma évolue vers une meilleure maîtrise des interactions entre les produits et les procédés de fabrication. “La démonstration d’une meilleure compréhension des sciences pharmaceutiques et de production peut créer la base d’une approche flexible de la réglementation. Ce degré de flexibilité est lié au niveau de connaissance scientifique fourni”, explique l’ICH Q8, guideline tripartite rédigé en 2005 par l’ICH.
Il s’agit de l’approche Quality By Design qui vise, dans le développement d’un médicament, à mieux explorer les caractéristiques des molécules, à mieux maîtriser le procédé de fabrication en l’explorant aux limites et en identifiant les paramètres critiques. La finalité est d’assurer que la qualité ne soit plus assurée par l’atteinte d’une valeur cible, mais par un ensemble de valeurs (Design Space), espace de conception dans lequel les paramètres de production peuvent varier sans altérer la qualité du produit final.
Les requis de production sont donc croissants : du développement à la production en continu, à l’intégration d’instruments de mesures analytiques en ligne (PAT – Process Analytical Technology) :
– Pilotage du procédé : ergonomie des interfaces opérateur, fiabilité, précision et finesse des régulations, intégration des différentes parties du process pour un fonctionnement fluide et maîtrisé, la gestion des alarmes,
– Génération de données : pertinence, précision et représentativité des données du processus pour le développement et l’utilisation ultérieure en production
– Intégration sur la ligne de production d’instruments de contrôle qualité : représentativité de la mesure, précision de l’instrument et éventuellement rétrocontrôle sur la régulation du process.
A ces requis de production, il convient d’ajouter les requis réglementaires concernant :
– La gestion des certificats d’accès,
– La gestion des recettes,
– La protection des données,
– L’édition et la sauvegarde des données de production ou rapports de production,
– L’audit trail,
– Les signatures électroniques.
Et les requis utilisateurs pour la communication et l’échange d’information avec :
– Les autres systèmes de gestion de production,
– La gestion électronique des données (rapports de lot, log books),
– La gestion centralisée des accès utilisateurs,
– L’affichage des courbes de tendances et l’exploitation statistique des données,
– La maintenance logicielle et du système global.
Pour satisfaire ces différents requis, le système informatisé devra intégrer :
– Des applications spécifiques : supervision et interfaces homme/machine, programmes automates, techniques de régulation spécifiques, traitement d’analyses issues des instruments de mesure, …
– Le traitement et l’organisation des différentes bases de données,
– La maintenance et outils de diagnostics du système de production,
– Des capacités de communication et les différents protocoles pour la communication entre les couches informatiques (PC, serveurs) et les composants industriels propres aux activités de terrain : automates, réseau industriel client, équipements autonomes, composants d’entrées/sorties ou d’organes de contrôle moteurs…,
– De la puissance de calcul pour le fonctionnement fluide des applications, le traitement statistique des données du passé et la gestion des échanges entre les différents modules et composants du système,
– De la capacité de stockage pour la sauvegarde des données, l’organisation des échanges d’information de synthèse avec des systèmes tiers.
Les systèmes deviennent plus élaborés, les composants hardwares sont plus nombreux et de plus en plus, de mieux en mieux, communiquants.
Les différentes applications doivent coexister et fonctionner ensemble au travers d’échanges d’informations orchestrées suivant un ordre de marche cohérent, cadencé et fiable.
Les enjeux de la validation sont donc de tenir compte de tous les éléments :
– Les systèmes de contrôle-commande – ensemble supervision/automate : robustesse du fonctionnement, pilotage du procédé, acquisition des données de production, la traçabilité des matières engagées (production en continu)
– PAT : représentativité de la production, analyse des mesures et calcul des paramètres critiques représentatifs de la qualité du process, rétrocontrôle sur la régulation du process (éventuel)
– Les bases de données locales : pertinence des informations, précision, fréquence d’acquisition
– La protection du système : gestion d’accès, intégrité des données de configuration et collectées sur base de l’activité de production, traçabilité des changements et audit trail 21CFR part11
– Les interfaces entre les différents systèmes (serveur à serveur, PC/PLC/Réseaux, équipements intelligents, capteurs intelligents, …) : les différents échanges d’information, la gestion de la charge CPU
– Les échanges de données avec le réseau clients : gestion d’accès, rapatriement des données (intégrité), intégration MES
– La maintenabilité du système
– Le maintien en conditions opérationnelles.
La tendance n’est donc pas à la réduction des informations, ni à la simplification des sources et formats de communication.
Les données se multiplient (équipements, instruments, systèmes ouverts, interfaces de liaison, serveurs, …) ou peuvent également apporter de nouveaux paramètres pour des process existants.
Ces informations apportent de meilleures connaissances des paramètres process pour leur définition, la maîtrise de la production ou la libération en temps réel mais entrainent le risque de se noyer dans trop d’informations, d’avoir des imbrications mal définies entre les différents systèmes et finalement un processus non robuste.
L’enjeu majeur est d’avoir une conception entre les différents systèmes centré sur la conduite du procédé, de ses informations et de leur exploitation.
Le passage d’un système automatisé vers un pilotage du procédé par les données amène une nouvelle complexité, de nouveaux risques à prendre en considération. La démarche de production maitrisée (QBD, validation continue) viendra conforter les aspects d’assurance qualité de la production.
Cette évolution se répercute également sur les exercices de qualification et validation avec la qualification des aspects mécaniques, de systèmes automatisés, de systèmes d’information et de l’approche analytique du PAT.
La coordination des activités d’ingénierie avec les activités de validation devient primordiale pour réussir le lancement en production des équipements et du procédé.
L’entreprise pharma est la recherche d’une meilleure maîtrise des risques (reputation risk) via les analyses prédictives et les propositions contextuelles d’actions.
Pour être performante dans la durée, l’entreprise pharma est aussi à la recherche d’éléments de synthèse des informations pertinentes, notamment pour les analyses des déviations, pour la constitution de rapports automatisés complets (production et qualification de ses systèmes).
La traçabilité devient un enjeu commercial ; les spécifications sont des points critiques (paramétrages) comme les exigences de l’AQ (dossier GAMP5/cat4). La traçabilité est aussi un facteur déterminant dans une supply chain mondiale et un facteur de lutte contre la contrefaçon.
Les nouvelles technologies, si elles sont bien analysées, intégrées et maîtrisées tout en répondant aux exigences des départements SI, production, QA et maintenance sont les outils incontournables de l’entreprise de production de médicaments et traitement de demain :
– Technologie flexible “plug&play”
– Technologies sans fil
– Dashboard de pilotage des
systèmes centralisés, globaux,
validés avec entrée par métier/profils
– Géolocalisation des équipements, des productions en transit
– Cloud
L’industrie pharmaceutique est en route vers de nouveaux challenges pour le pilotage de la production.
Celle-ci et ses partenaires devront comprendre, mutualiser et maîtriser les différentes technologies et leur évolution, tout en intégrant les aspects réglementaires applicables pour chaque élément.
La réussite passe plus que jamais par un partenariat fort, la compréhension et la maîtrise technologique pointue.

Anne CASSART – BiiON
anne.cassart@biion.com