Sommaire
- Filtration stérilisante sur BFS Réglementation et usages pour garantir la stérilité
- Vaccines and other biological pharmaceuticals aseptic packing utilizing Blow/Fill/Seal technology
- Cahier Pratique – Maitrise des gaz à usage pharmaceutique
- L’importance de la maîtrise du poids des contenants pharmaceutiques faits par BFS
- Single best way to deliver
- Propositions du GIC A3P pour la révision de l’Annexe 1
- Management – «Quelques pensées sur la direction de sites et le leadership, Partage d’expérience et de petits trucs…»
De longue date, le procédé Blow Fill and Seal (BFS) permet grâce à une seule machine la production de flacons en matière plastique contenant des liquides de diverses natures : alimentaires, techniques ou pharmaceutiques.
En pharmacie, un des principaux intérêts est de pouvoir produire aseptiquement des liquides stériles sensibles à la chaleur. Dans ce cas une filtration stérilisante de la solution s’impose, la matière plastique étant stérilisée pendant l’étape d’extrusion, les étapes suivantes étant réalisées en aseptique, la machine et ses annexes étant elles habituellement stérilisées à la vapeur. Cette filtration stérilisante est une opération critique pour la stérilité finale du produit et elle doit répondre à des textes réglementaires particulièrement la ligne directrice 1 des Bonnes Pratiques de Fabrication (BPF). Différentes implantations des filtres stérilisants sont possibles. Toutes doivent conduire à une maîtrise de la stérilité de la filtration stérilisante avec des stratégies propres à chaque entreprise mais présentant chacune leurs limites.
Ces différentes options sont présentées et discutées dans le texte qui suit.
Rappels réglementaires
La ligne directrice des Bonnes Pratiques de Fabrication (BPF) portant sur les médicaments stériles et complétée par les textes sur les produits ne pouvant pas être stérilisés dans leur récipient final précise en particulier que :
• L’intervalle de temps entre le début de la préparation de la solution et sa stérilisation ou sa filtration sur un filtre antimicrobien doit être le plus bref possible.
• La biocharge (contamination microbienne) doit être contrôlée avant la stérilisation. Une valeur limite doit être fixée pour la contamination microbienne immédiatement avant la stérilisation, limite qui est fonction de l’efficacité de la méthode utilisée (BPF 2014 1bis §LD1-80).
• Etant donné que la filtration comporte plus de risques que les autres méthodes de stérilisation, une seconde filtration sur filtre antimicrobien stérile, immédiatement avant la répartition, peut être recommandée. La filtration stérilisante finale doit être effectuée aussi près que possible du point de répartition (BPF 2014 1bis §LD1-111).
• L’intégrité des filtres stérilisés doit être contrôlée avant usage et confirmée immédiatement après usage par une méthode appropriée telle que les tests de point de bulle, de diffusion ou de maintien en pression.
• La durée de filtration d’un volume connu de solution et la différence de pression entre l’entrée et la sortie du filtre doivent être déterminées pendant la validation et toute divergence significative durant le processus habituel de fabrication notée et examinée. (BPF 2014 1bis §LD1-113).
• Le même filtre ne doit pas être utilisé pendant plus d’une journée de travail sans que cette pratique n’ait été validée (BPF 2014 1bis §LD1-114)
Il ne faut pas oublier non plus que les filtres stérilisants sont choisis et validés pour garantir l’efficacité de la filtration stérilisante.
Implantation des filtres stérilisants sur les lignes de production et sur les remplisseuses BFS
Depuis de nombreuses années les usines et Excelvision en particulier, ont développé des pratiques pour répondre aux exigences réglementaires et garantir la qualité et la stérilité des produits.
Lorsque les produits sont remplis sur une période longue, une première filtration stérilisante dans une cuve de stockage aseptique est opérée pour garantir un stockage aseptique du produit.
Une seconde filtration stérilisante est ensuite opérée sur la remplisseuse. Par convention nous appellerons ce filtre : filtre de sécurité.
Les fabricants de machine BFS proposent généralement deux implantations des filtres produits.
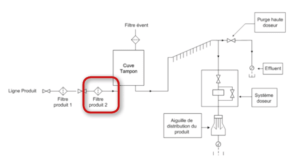
Principe de maîtrise de stérilisation par filtration stérilisante
Pour assurer l’efficacité de la filtration stérilisante d’un filtre stérilisant (0,22μm absolu) 3 conditions principales sont requises :
• Assurer un niveau de contamination du produit à filtrer le plus faible possible en contrôlant sa biocharge,
• Garantir pendant la filtration le maintien des paramètres en dessous des maxima validés pour la pression, le débit et la durée de filtration,
• Effectuer la vérification de l’intégrité des filtres en place après stérilisation selon les paramètres validés (Point de bulle ou test de diffusion) avant et après usage.
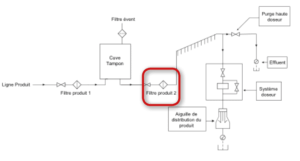
Stratégies possibles de maîtrise de la filtration stérilisante
Dans le cas où le produit est filtré sur filtre stérilisant dès le transfert en cuve de stockage aseptique la maîtrise de la stérilisation par le filtre stérilisant devra être atteinte dès cette étape avec contrôle de la biocharge avant cette filtration, respect des paramètres de filtration validés et contrôle de l’intégrité du filtre avant et après usage.
L’intégrité du filtre de sécurité placé au plus près du point de remplissage reste ensuite à vérifier. Les avantages et les inconvénients liés à l’implantation de ce filtre sont présentés dans les tableaux ci-après.
Cas de 2 filtres avant cuve tampon
 |  |
Cas de 1 filtre avant et 1 filtre après cuve tampon
 |  |
Conclusion
Pour répondre aux aspects réglementaires et garantir la maîtrise de la stérilité, la conception des remplisseuses BFS bien que très avancée mérite encore que des solutions soient proposées pour permettre la réalisation de tests d’intégrité des filtres avant usage.
L’objectif est de garantir le maintien de circuits à l’état stérile à l’amont et/ou à l’aval du filtre à contrôler.
Dans les conceptions actuelles, la position en amont de la cuve tampon de ce filtre de sécurité permet d’ores et déjà de supprimer le risque de perte de stérilité en aval du filtre lors de la réalisation du test d’intégrité. Des solutions existent également pour éviter la perte de stérilité à l’amont du filtre chez certains constructeurs dans cette situation : par exemple par mise en place d’un filtre à air surmontant ce filtre produit stérilisé en même temps que la machine.
Le contrôle du filtre au plus près du point de remplissage avant usage nécessite pour être réalisé de garantir l’absence de risque pour la stérilité. Cette exigence doit être prise en compte dès la conception de l’équipement.
Compte-tenu de notre expérience (efficacité de la première filtration stérilisante, maintien en condition aseptique des solutions, qualité des filtres, fiabilité des stérilisations …) corroborée par les résultats des Media Fill Test, nous continuons à nous questionner sur la pertinence d’un contrôle d’intégrité du filtre de sécurité avant usage.
Le montage nécessaire à de tels contrôles ne représente-t-il pas un risque supérieur au bénéfice apporté ?

Jean JAILLOT – EXCELVISION
jaillit.excelvision@fareva.com
Partager l’article
Bibliographie
- BPF Européennes 2014 1 bis pour les lignes directrices 1 Fabrication des médicaments stériles paragraphe Filtration des médicaments qui ne peuvent pas être stérilisés dans leur récipient final
- Defining a strategy for the Validation and Qualification of Sterile Filtration Processes of Investigational Medicinal Compounds (Ross W. Acucena Regulatory Consultant, Provantage Services EMD Millipore March 4, 2014 @ PDA Metro Chapter Dinner)




