Sommaire
- Les systèmes de confinement : Sources de sécurité et d’un business amélioré
- Stratégies de mise en place et de gestion de la bioproduction selon les BPF
- Disinfectant Validation : a roadmap for regulatory compliance
- Cahier Pratique : Des outils de résolution de problèmes dans le cadre d’un programme d’amélioration continue de la Qualité
- Collaboration entre Transgene & Pall Life Sciences pour le développement d’un procédé
- De l’importance des intégrations dans LIMS
- Freeze drying with collapse is not necessarily bad for stability and can reduce cost
- Prenez-vous trop de risques ? Adoptez la nouvelle approche qualité « QbD » pour vos cycles de lyophilisation
- Management – «Quelques pensées sur la direction de sites et le leadership, Partage d’expérience et de petits trucs…»
Nouvelles perspectives pour le développement clinique
L’industrie pharmaceutique a connu des transformations majeures au cours des quinze dernières années qui ont considérablement modifié la gestion des opérations de production. De grands sites centralisant l’ensemble des processus, nous sommes passés à une approche coordonnée multi-sites, optimisant ainsi les capacités disponibles dans les usines. Par ailleurs, les modèles de recherche se sont adaptés pour étendre les axes de recherche et minimiser les risques, avec de nombreux partenariats extérieurs. Cette approche de l’innovation a permis l’émergence d’une offre de sous-traitance large reposant sur des technologies et des savoir-faire spécifiques
Désormais, la biopharmacie représente l’essentiel de la croissance dans le secteur pharmaceutique. Ce dynamisme repose sur un grand volume de produits en cours de développement souvent portés par des PME et de jeunes start-up. En se concentrant sur les travaux cliniques, ces entreprises optent le plus souvent pour la production en sous-traitance de leurs produits biologiques. Cette démarche permet d’amener en phases cliniques des candidats médicaments, en limitant les investissements, que souvent ces petites entreprises ne peuvent pas financer.
Cependant, si la production intégrée et la construction d’un site n’apparaissent comme une option qu’aux stades de développement les plus avancés, je suis aujourd’hui convaincu que les solutions telles que les équipements à usage unique, les infrastructures modulaires et de nouvelles offres de services comme celle proposée par Accinov, permettent aux structures qui le souhaitent de porter plus loin le développement de leur produits et d’acquérir un savoir-faire de valeur pour la société.
André DUPONT, Pharmacien Responsable, Directeur Général Délégué.
Enjeux et défis de la bioproduction
L’avènement des biotechnologies a entrainé de profonds changements dans l’industrie pharmaceutique au cours des trente dernières années. Le travail complexe avec des microorganismes vivants a succédé à la simple réaction chimique A+B. Le plastique et les technologies à usage unique tendent à remplacer les cuves en inox. Appuyée par des outils analytiques toujours plus puissants, la règlementation a elle aussi connu une évolution rapide. Enfin, l’arrivée de nouveaux acteurs et la croissance des marchés émergents ont fortement intensifié la pression sur les coûts de fabrication.
Certes, il est particulièrement difficile d’évoluer pour rester compétitifs, mais cela étant, ces changements se sont également accompagnés de spectaculaires avancées. Les technologies de production et les sciences analytiques rendent désormais possible la création de nouvelles lignées et de nouveaux clones cellulaires en quelques semaines, le séquençage de génomes entiers en quelques jours ainsi que la réalisation d’analyses en quelques minutes.
Si, les échecs restent nombreux et le taux d’attrition élevé durant les premières phases cliniques, le processus de développement a globalement accéléré et les besoins de grandes quantités de matériel biologique apparaissent rapidement dans le planning des projets. En conséquence, la bioproduction – la culture de bactéries, levures et autres cellules eucaryotes – est devenu un enjeu important pour les petites entreprises qui atteignent les phases cliniques, mais aussi pour les grands groupes pharmaceutiques, qui cherchent à optimiser leurs capacités et l’utilisation de leurs ressources. Pour répondre à ces besoins de production et à des enjeux de flexibilité, de qualité et de coûts, de nouvelles technologies et offres de services ont permis l’émergence de modèles alternatifs, hybrides, entre le tout internalisé ou externalisé.
Critères stratégiques pour la bioproduction clinique
De nombreux risques pèsent sur les étapes précoces du développement clinique et les ressources financières à ce stade sont souvent limitées. Il apparait alors difficile d’engager et de justifier d’importantes dépenses pour des investissements non productifs tels que les bâtiments et infrastructures. Cependant, les opérations industrielles s’avèrent difficiles à relocaliser en interne à des stades de développement plus avancés. En conséquence, la flexibilité, les coûts et les délais sont les critères clés pour évaluer les meilleures solutions de bioproduction.
La flexibilité est synonyme d’ajustement de la capacité en fonction de l’évolution des besoins. Cela peut intégrer une souplesse technique permettant la mise en œuvre de technologies différentes à des échelles variées. C’est également une flexibilité organisationnelle pour répondre rapidement à toute modification dans le programme de développement du médicament. Aucun compromis n’étant acceptable sur la qualité ou la sécurité des produits, les critères financiers sont tout aussi cruciaux. Les opérations doivent être menées dans un environnement hautement qualifié et par une main d’œuvre compétente. Il faut également garder à l’esprit, le coût des marchandises et de la logistique ; une attention particulière est requise à ce propos en raison de l’obligation de mettre en place des procédures de traçabilité et de contrôle de l’ensemble des matières.
Le dernier critère est le temps. La livraison d’un produit conforme dans les délais et en respectant les coûts est un enjeu majeur lors du développement d’un médicament. Mis à part, la construction d’un site, qui est en soi un projet sur plusieurs années (conception des installations, construction et processus d’autorisation règlementaire), le contrôle qualité et certains tests libératoires peuvent représenter des délais importants par rapport aux seules étapes de production et si des méthodes alternatives rapides existent, toutes ne sont pas encore forcément reconnues par les autorités. En amont, le développement analytique représente également une part importante des activités.
Mise en œuvre des opérations
Les modèles opérationnels classiques s’appuient sur la fabrication en interne et le façonnage. Cela étant, de nouveaux modèles sont disponibles et fournissent plus de flexibilité et de contrôle. Il est aujourd’hui possible, par exemple, de concevoir des unités de bioproduction dans un conteneur et de les expédier à destination de votre site ou ailleurs. Il est aussi envisageable d’avoir recours à des isolateurs de petite dimension pour réaliser une bioproduction certifiée BPF même dans des espaces restreints de zones classées. Outre ces options, Accinov propose une solution complète pour la fabrication basé sur un modèle hybride innovant : la plateforme associe des infrastructures à des services de support qualité et règlementaire pour permettre la mise en œuvre d’opérations de bioproduction conformes aux BPF. Cette offre innovante constitue réellement un modèle alternatif pour maitriser la planification et les coûts tout en conservant le contrôle du savoir-faire en interne.
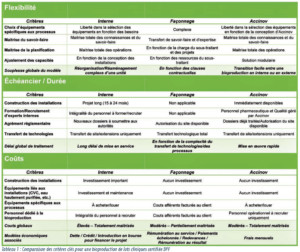
Le tableau 1 souligne et résume les différences entre les trois modèles : fabrication en interne, façonnage et ce nouveau modèle de conduite des opérations. Le choix d’un modèle doit s’appuyer sur l’évaluation de critères fondamentaux ; la structure des coûts, l’investissement en capital, l’expertise et la réactivité sont des paramètres stratégiques.
La conception et la maintenance des installations pharmaceutiques demandent de grands efforts et des ressources dédiées. Opter pour un tel projet se révèle donc généralement difficile pour les premières étapes cliniques d’un programme de développement, les capitaux étant plutôt consacrés à la R&D et aux études précliniques/ cliniques. Néanmoins, l’expertise associée à des développements nouveaux est souvent unique et spécifique au produit. Dans ce cas, il peut être préférable de réaliser les opérations en interne. Cela permet notamment un retour d’expérience important sur le comportement des produits et une meilleure connaissance des attributs qualités ayant potentiellement un impact lors des essais cliniques.
Actuellement, le recours à des façonniers est l’option privilégiée par les petites entreprises et les start-ups. En effet, ce modèle économique apparait plus pratique pour des équipes orientées vers la recherche, dans la mesure où il permet de disposer des produits biologiques sans devoir recruter des équipes entièrement dédiées à la production ou aux fonctions supports (CQ, AQ, …). Cela étant, ce modèle implique un transfert de technologies susceptible d’être long en cas d’innovation de rupture et une moindre maitrise du savoir-faire, partagé avec un partenaire. Par conséquent, une attention particulière doit être portée aux accords techniques et contrats commerciaux liant les deux partenaires.
Solution alternative et hybride, Accinov facilite la mise en place d’une bioproduction conforme aux BPF en utilisant des ressources internes, dès les premières étapes cliniques, et sans compromis sur la qualité et le contrôle du savoir-faire.
Modèle hybride innovant pour la bioproduction BPF
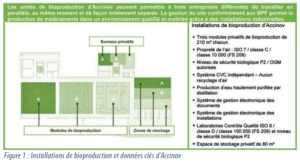
Le nouveau modèle proposé s’appuie sur un bâtiment neuf de 6 500 m2, conçu pour répondre aux exigences du développement clinique (Figure 1). L’accès à l’infrastructure est fourni dans le cadre d’une offre de services plus large, comprenant la gestion d’installations conformes aux BPF ainsi qu’un support et une expertise pharmaceutiques. En effet, le Pharmacien Responsable et le service d’assurance qualité du site garantissent la conformité avec les BPF des activités réalisées par les entreprises.
Avec un système de management de la qualité déployé et géré en interne, c’est le service pharmaceutique et qualité qui libère les matières premières et se charge de la certification des lots de médicaments pour les entreprises accueillies sur place. Ils assurent également la qualification des fournisseurs et l’audit des tiers impliqués dans les opérations. Le personnel permanent prend aussi en charge la gestion du site, incluant la maintenance technique et la coordination des services comme la sécurité, le nettoyage et les livraisons. Le personnel des entreprises hébergées peut alors se consacrer aux activités stratégiques, sans se soucier des contraintes liées à l’exploitation d’un site de production pharmaceutique.
Les unités de bioproduction d’Accinov peuvent permettre à trois entreprises différentes de travailler en parallèle, au même moment et de façon totalement séparée. La gestion du site conformément aux BPF permet la production de médicaments dans un environnement qualifié et maitrisé grâce à des installations industrielles.
Ce nouveau modèle est à même de répondre à différents besoins, en fonction de la maturité de l’entreprise, du type de produits ou de son stade de développement (Tableau2). En effet, les petites organisations pourront trouver un environnement de travail complet pour produire elles-mêmes leurs premiers lots cliniques. Les sociétés expérimentées pourront quant à elles rapidement initier leurs activités BPF, comme elles l’auraient fait dans leurs propres usines. Par ailleurs, les services à des tiers peuvent également être assurés, sans risque, grâce à la possibilité d’auditer les dossiers du site.
Ainsi, ce modèle hybride proposé constitue une réelle opportunité pour les entreprises développant des bio- médicaments. Il permet de gérer les opérations, depuis la R&D jusqu’à la fabrication, avec ses propres ressources, en maîtrisant pleinement les coûts et délais. cette approche nouvelle permet de mettre en place des opérations conformes aux BPf et d’envisager des modèles économiques et de partenariats nouveaux.
À propos
Accinov est une infrastructure de Lyonbiopôle, le pôle de compétitivité Santé de la région Rhône-Alpes. Le pôle de compétitivité Lyonbiopôle se positionne aujourd’hui comme l’animateur et le guichet unique de la santé en région Rhône- Alpes. Depuis sa création en 2005, le pôle mène une politiqued’infrastructures forte dans le but de fournir aux entreprises le support le plus complet possible. Lyonbiopôle gère ainsi un business center et l’accès à des laboratoires de R&D P2 et P3.

André DUPONT – ACCINOV
andre.dupont@accinov.com