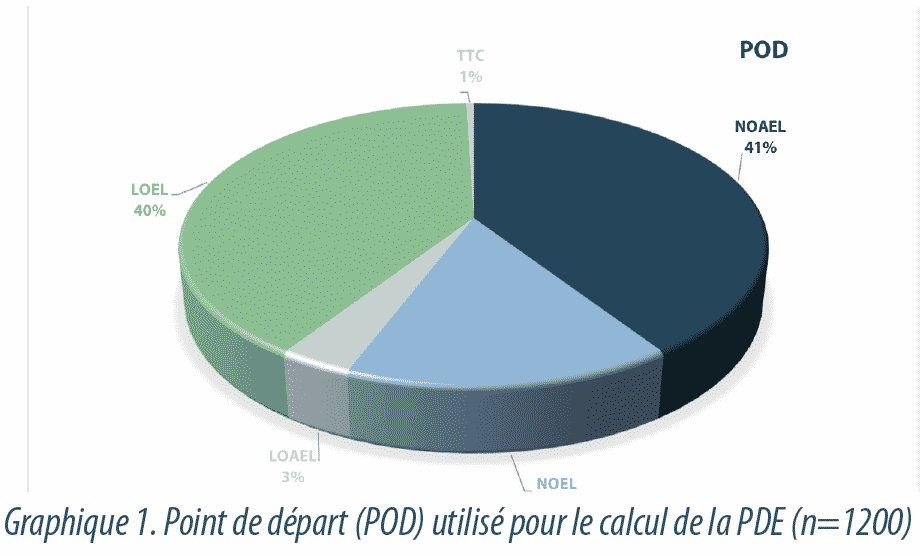Sommaire
- EU Annex 1 draft : Propositions du GIC A3P Annexe 1.
- Data Integrity : vers la mise en place d'un Data Management.
- Le Lien entre réglementation, système qualité & Data Integrity.
- Migration dans le Cloud & Data Integrity.
- Incidences du calcul de la PDE en tant que limite d'exposition pour l'analyse de risques dans des installations partagées.
- L'IVDR signale la refonte de l'industrie de diagnostic in vitro.
- Tungsten in the production of prefillable syringes. Also possible without tungsten.
Bilan après la mise en œuvre de la Directive de l’EMA (EMA/CHMP/CVMP) SWP/169430/2012) relative à l’établissement, sur la base de critères de santé, de limites d’exposition lors de la fabrication de différents médicaments dans des installations partagées.
1. Introduction
En novembre 2014, l’Agence européenne des médicaments (EMA) a publié la Directive EMA/CHMP/ CVMP/SWP/169430/2012(1) relative à l’établissement de limites d’exposition lors de la fabrication de différents médicaments dans des installations partagées.
Par ailleurs, en janvier 2015, la Commission européenne a également révisé les chapitres 3 et 5 du Guide des BPF de l’UE, en mettant à jour les sections sur la prévention des contaminations croisées. Ces mises à jour sont entrées en vigueur en mars de cette même année. Par ailleurs, l’Annexe 15 du Guide des BPF de l’UE (point 10.6) stipule que “Les limites de contamination résiduelle du produit doivent reposer sur une évaluation toxicologique”. Les dates de mise en œuvre du nouveau Guide de l’EMA sont juin 2015 pour les nouveaux produits et décembre 2015 pour les produits existants (avec un report de ces délais limites d’un an pour les produits vétérinaires).
Jusqu’alors, on utilisait les valeurs limites de 10 ppm ou 1/1000 de la dose clinique la plus basse pour les validations de nettoyage. L’utilisation des limites traditionnelles se traduisait, d’une part par des limites excessivement restrictives pour les produits à faible toxicité, dépassant de loin les limites nécessaires pour garantir la sécurité du patient. Et d’autre part, les limites traditionnelles n’offraient pas une protection suffisante pour les produits considérés comme ayant une toxicité élevée.
Jusqu’alors les catégories ayant les risques les plus élevés concernaient “certaines hormones”, “certains cytotoxiques”, etc., sans critères spécifiques.
La publication de la Directive de l’EMA implique de déterminer les limites d’exposition en fonction de critères toxicologiques et en s’appuyant sur les caractéristiques inhérentes de chaque substance. La PDE (“Dose Journalière Admissible”) est calculée à partir de données pharmacologiques, toxicologiques et pharmacocinétiques et est similaire à la valeur EJA (Exposition journalière admissible) décrite dans le RiskMaPP de l’IPSE (International Society for Pharmaceutical Engineering)(2). Les deux valeurs représentent la dose journalière maximale d’une substance qui n’est pas susceptible d’entraîner des effets indésirables à un individu qui serait exposé à cette dose ou à une dose inférieure, chaque jour, pendant toute une vie.
Afin de faciliter pour l’industrie pharmaceutique la mise en œuvre de ces nouvelles réglementations des BPF, l’équipe d’experts en toxicologie d’Azierta a lancé en tant que prestataire de service extérieur en janvier 2015, un projet de calcul des valeurs de la PDE pour les Substances Actives / Active Pharmaceutical Ingredients (“API”).
Bénéficiant d’un effet d’expérience unique en Europe pour avoir conduit l’évaluation toxicologique et l’élaboration de 1200 monographies PDE, nous avons procédé à une méta-analyse approfondie des données obtenues. Une classification des valeurs de la PDE a été établie, distinguant 5 groupes et affectant un niveau de dangerosité à chacun d’entre eux. Les résultats ont été analysés en fonction des groupes thérapeutiques de la classification ATC (Classification anatomique, thérapeutique, chimique).
2. Méthodologie
2.1 Calcul de l’Exposition Journalière Admissible (PDE)
150 laboratoires pharmaceutiques internationaux ont commandé un rapport PDE pour leur API (Active Pharmaceutical Ingrédient) selon leurs besoins. 1 200 substances actives au total ont été évaluées par une équipe d’experts AETOX /EUROTOX . La détermination de la valeur d’un PDE a été réalisée en suivant les procédures décrites dans les guides de référence suivants :
- ICH Topic Q3C (R4) : Impuretés – Ligne directrice pour les solvants résiduels (CPMP/ICH/283/95)(3)
- VICH GL18(R) : Impuretés – Solvants résiduels dans les nouveaux produits vétérinaires, substances actives et excipients (EMA/CVMP/VICH/502/99-Rev.l)(4)
- ICH Q3D : Impuretés élémentaires (Sept.2015)(5)
L’évaluation toxicologique a été réalisée en fonction des recensions bibliographiques, en identifiant à la fois les dangers et les effets critiques associés à la substance. À partir de ces révisions, on a sélectionné le point de départ (“POD”) pour le calcul des PDE.
En fonction des informations disponibles on a déterminé individuellement la valeur de départ la plus appropriée à chaque cas. Les valeurs de POD utilisées sont les suivantes :
- Dose sans effet nocif observé “NOAEL”,
- Dose sans effet observé “NOEL”,
- Dose minimale avec effet nocif observé “LOAEL”,
- Dose minimale entraînant un effet observé (DMEO) “LOEL”,
- Seuil de préoccupation toxicologique “TTC”, .
En fonction du POD sélectionné, et tout en prenant en compte à la fois l’étude préliminaire et les données toxicologiques trouvées pour la substance concernée, sont déterminés les facteurs de sécurité (F1, F2, F3, F4, F5) de l’équation, décrite dans la littérature(3), de calcul de la PDE. Les valeurs de PDE obtenues sont exprimées en mg/jour.
2.2 Classification ATC
Pour effectuer l’étude des valeurs de PDE en fonction des groupes thérapeutiques, on affecte à chaque API son code ATC (code Anatomique, Thérapeutique, Chimique)(6).
Dans ce système de classification, les substances actives sont réparties en différents groupes en fonction des organes cibles pour leur effet thérapeutique et leurs propriétés thérapeutiques, pharmacologiques et chimiques. Dans un premier niveau, les API sont répartis en 14 principaux groupes qui sont ensuite chacun subdivisés en cinq niveaux. Pour cette étude, seule la classification jusqu’au troisième niveau a été prise en compte.
L’étude n’a pas pris en compte les produits limités à un usage vétérinaire.
2.3 Catégories de PDE
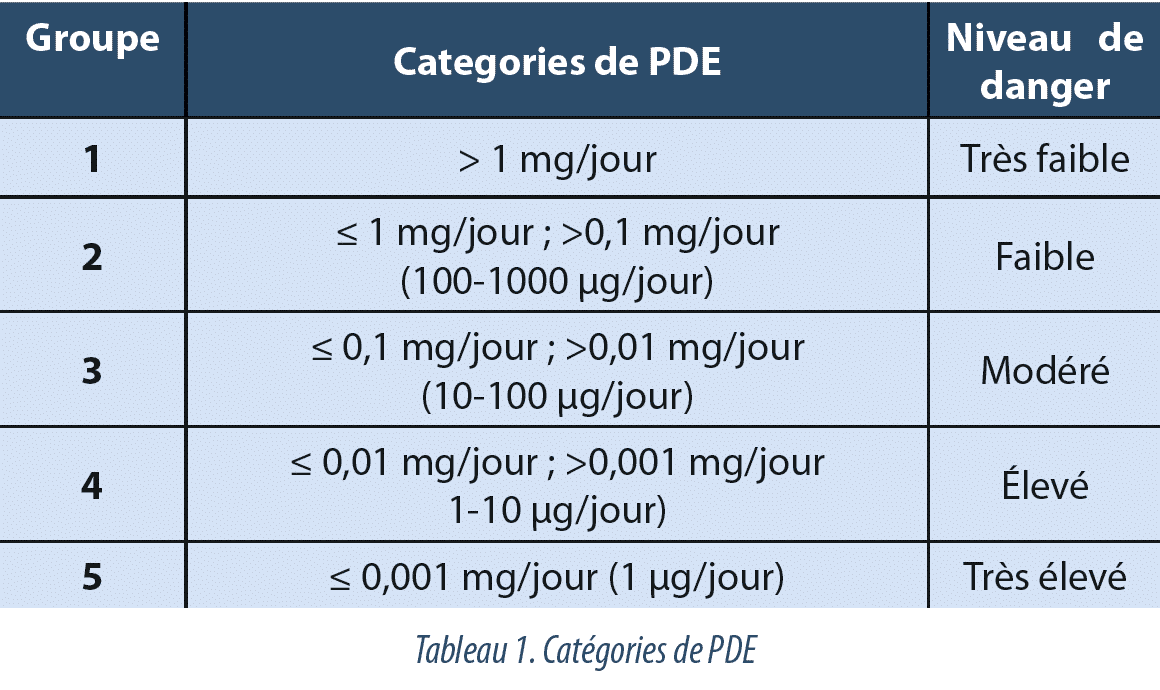
En s’appuyant sur les différentes catégories décrites dans les valeurs de Occupational Health for OEL (Limites d’exposition professionnelle) par Safebridge(7) et Naumann(8), nous avons établi différentes catégories de PDE pour analyser les résultats obtenus. Différents niveaux de substances dangereuses sont définis en fonction de leur valeur de PDE, 5 groupes (1 à 5) se différenciant par une toxicité croissante (Tableau 1).
Le Groupe 1 comporte les valeurs de PDE > 1 mg/jour et il est associé à un niveau très bas de danger. Le Groupe 2 comporte une plage de PDE située entre 1 et 0,1 mg/jour associée à un niveau de danger faible. Le Groupe 3 a une plage de PDE située entre 0,1 et 0,01 mg/jour avec un niveau de danger API modéré. Le niveau 4 correspond à un intervalle de PDE situé entre 0,01 mg/jour et 1 µg/jour et est associé à un niveau de danger élevé. Le dernier niveau, le groupe 5, comporte toutes les valeurs de PDE inférieures à 0,001 mg/jour (1 µg/jour) associées à un niveau de danger très élevé (Tableau 1).
3. Résultats et interprétation
3.1 Valeurs des points de départ (POD)
La Graphique1 représente les différents types de valeurs qui ont été utilisés comme point de départ pour déterminer la PDE. On a, dans la plupart des cas, utilisé pour le calcul des valeurs de NOAEL – NOEL tirées d’études toxicologiques (respectivement 41% et 15%). En raison de l’absence d’études avec ces valeurs ou d’un manque de fiabilité de ces dernières, la dose thérapeutique, telle que LOEL, a été utilisée dans 40% des cas. Pour les substances génotoxiques, lorsqu’aucune valeur NOAEL n’est disponible, la valeur TTC (Seuil de préoccupation toxicologique) a été utilisée comme point de départ (1%).
3.2 Types de substances (API)
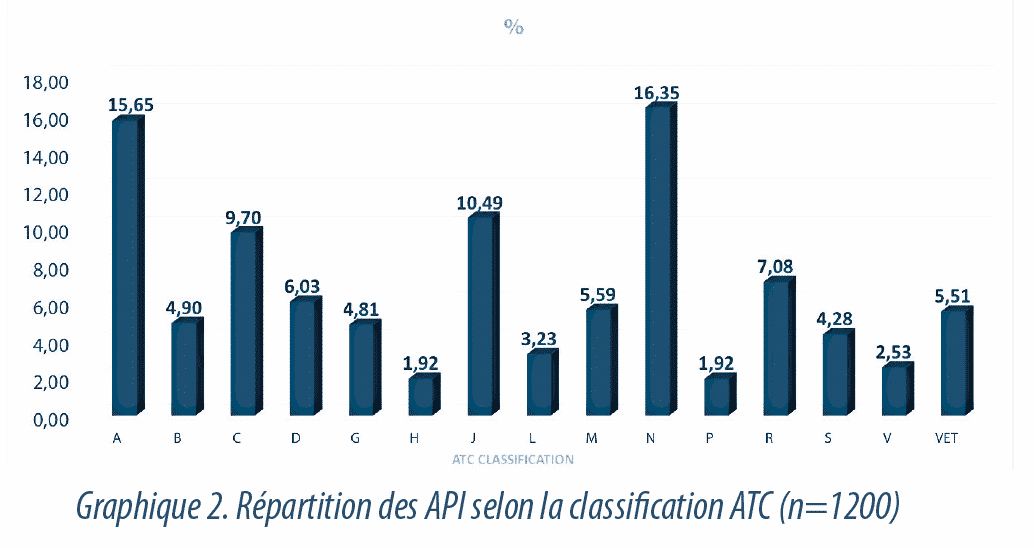
Dans la Graphique2, nous pouvons voir la répartition des substances en fonction des différentes classes thérapeutiques ATC, la plupart d’entre elles relèvent de la classe N (système nerveux) et de la classe A (voie digestive et du métabolisme) avec respectivement 16,3% et 15,6% du total de produits. 5% environ de toutes les substances sont destinées exclusivement à une utilisation vétérinaire et ont été exclues de ces études.
3.3 Catégorisation des PDE
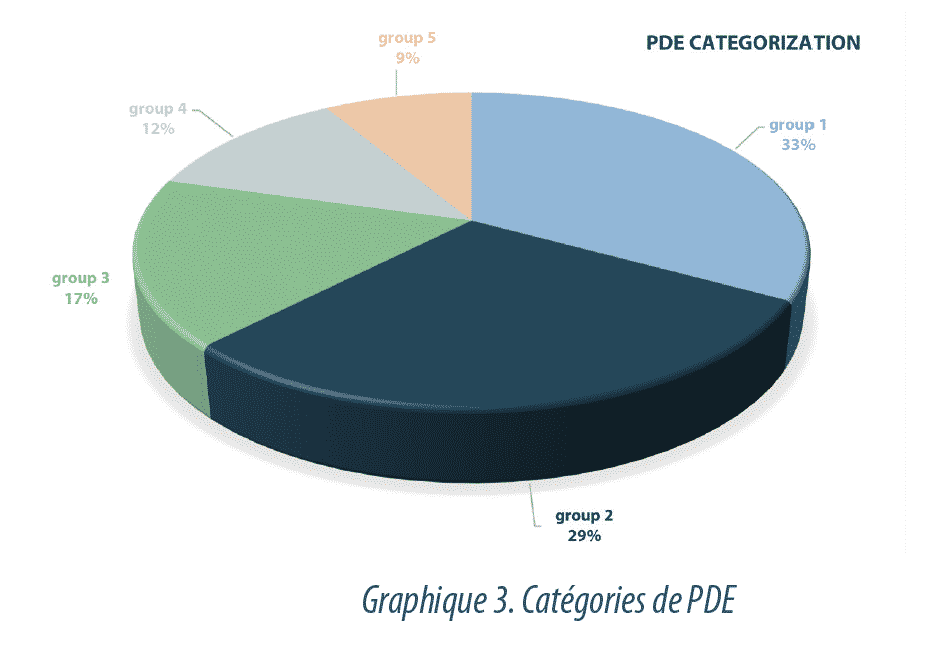
La Graphique3 représente la répartition des substances en fonction de la valeur de la PDE et du système de classification appliqué (5 catégories).
- 33% des substances évaluées appartiennent au groupe 1, ce qui signifie qu’elles ont une PDE >1 mg/jour, associée à un très faible niveau de danger.
- 29% des API évalués peuvent être inclus dans le groupe 2, avec une plage de PDE située entre 1 et 0,1 mg/jour. On estime que ces substances ont un niveau faible de dangerosité.
- 17% des substances ont des valeurs de PDE situées entre 0,1 et 0,01 mg/jour et sont considérées comme ayant un niveau modéré de danger.
- Le Groupe 4 comporte 12% des API de l’étude avec un intervalle de PDE situé entre 0,01 mg/jour et 1 µg/jour associé à un niveau de danger élevé.
- Le dernier niveau, le groupe 5, comporte toutes les valeurs de PDE inférieures à 0,001 mg/jour (<1 µg /jour). Ce sont des substances ayant un niveau très élevé de danger qui représente 9% du total des API étudiés.
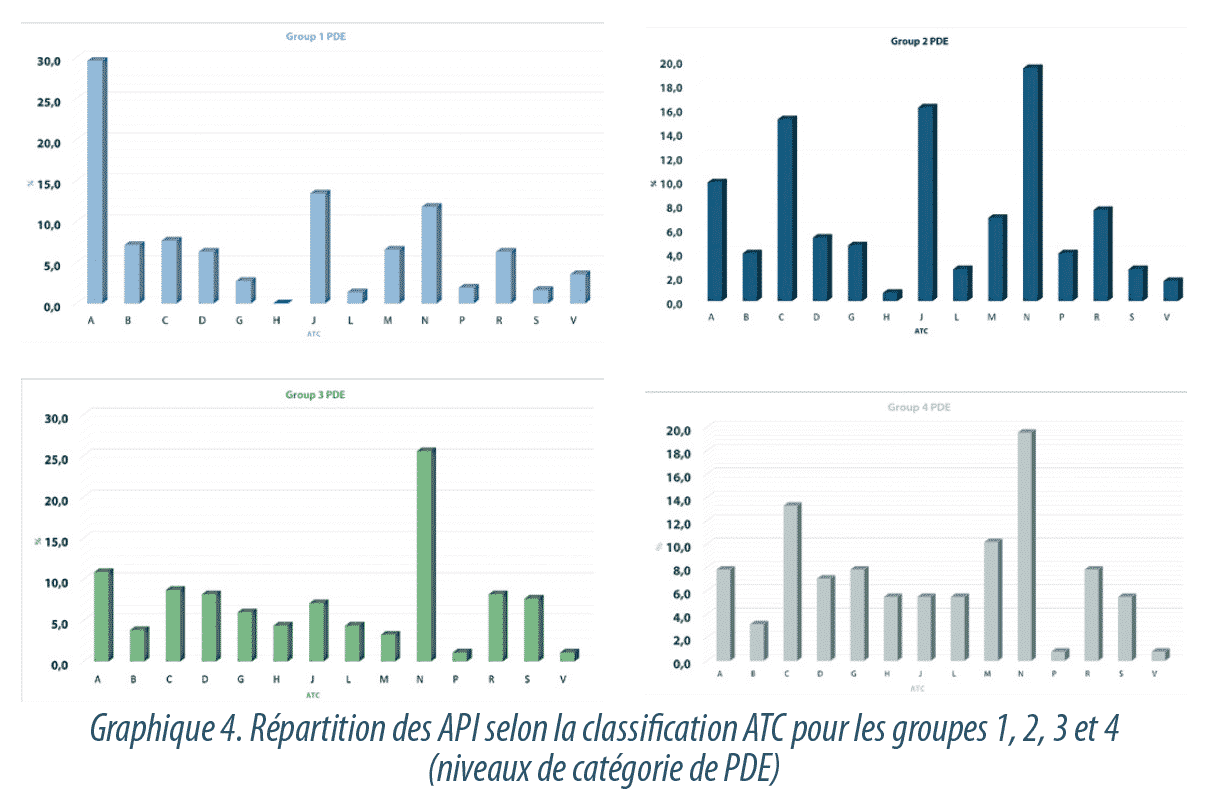
La Graphique 4 présente la répartition des différentes classes thérapeutiques en fonction des catégories de PDE pour les groupes 1, 2, 3 et 4.
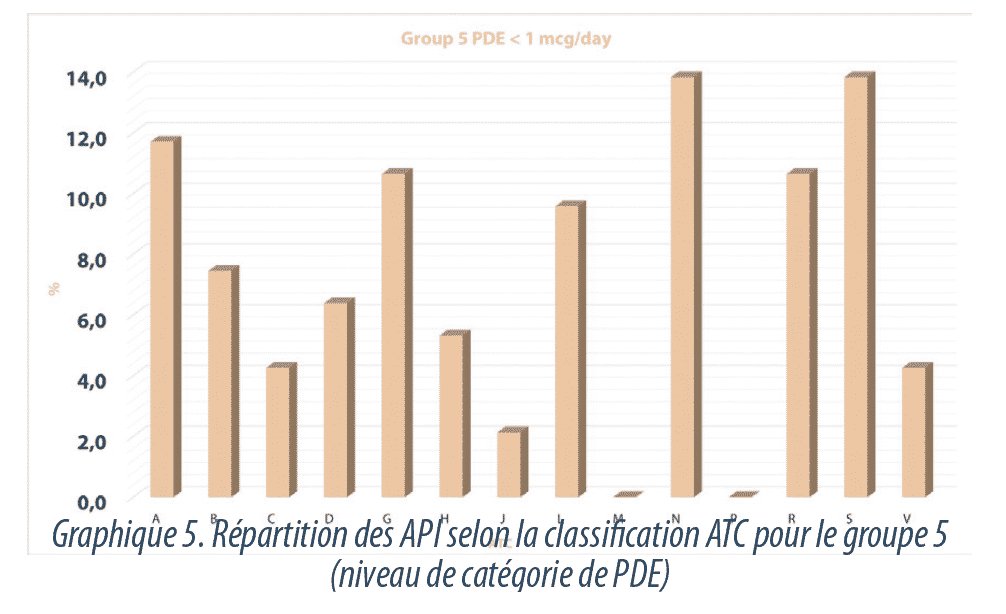
Un examen plus approfondi du groupe de substances présentant un niveau très élevé de danger (niveau 5, PDE <1 µg/jour) révèle qu’il n’est pas uniquement représenté par les substances attendues, notamment hormones et cytotoxiques (classes ATC H, G, L), mais par des substances qui appartiennent à d’autres groupes thérapeutiques, notamment N (système nerveux), S (organes sensoriels), R (système respiratoire) et A (voie digestive et du métabolisme) (Graphique5).
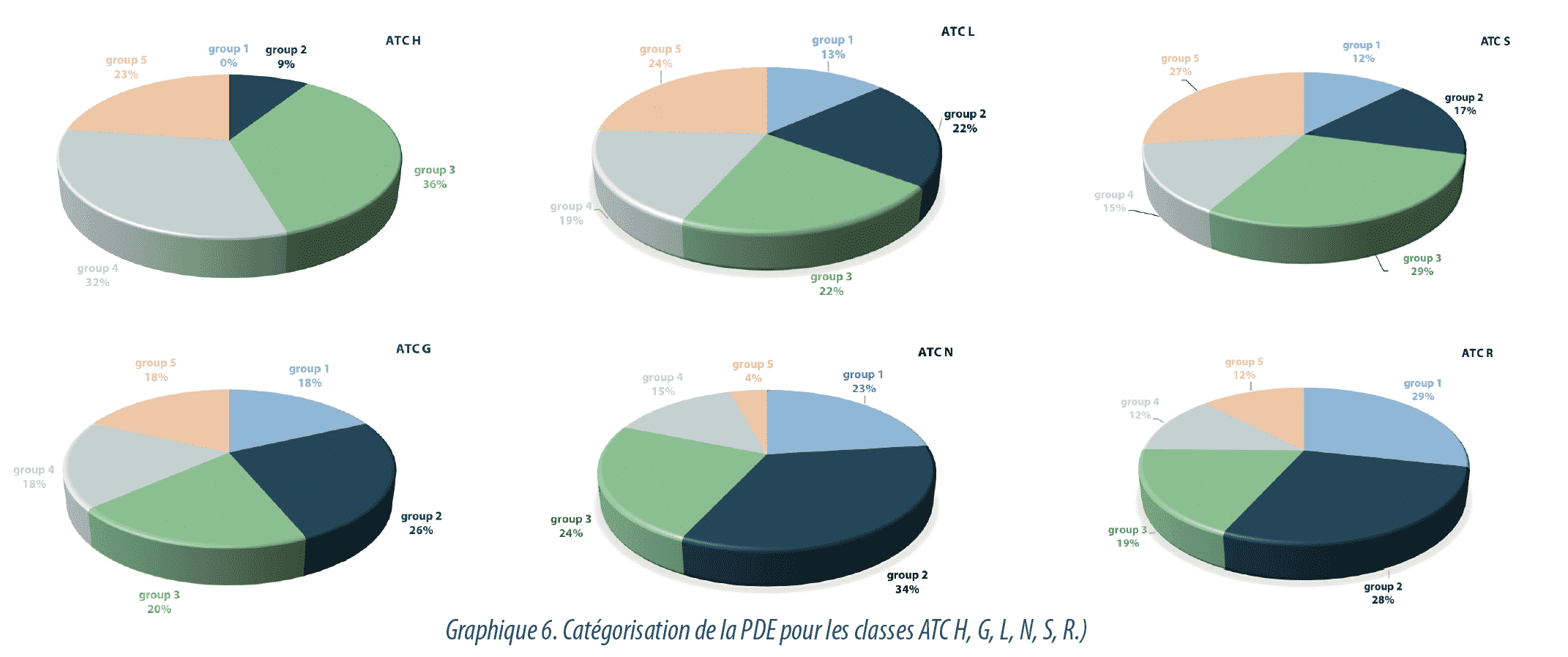
Nous avons donc analysé individuellement les groupes ATC qui contribuent le plus au groupe 5 de classification des PDE (G, H, L, S, N, R).
Comme prévu, les groupes ATC H, G et L, qui comportent les hormones et les agents cytotoxiques, ont un pourcentage plus élevé de produits ayant des valeurs de PDE <1 µg/jour, associés à un niveau très élevé de toxicité (groupe 5). Ces résultats isolés par groupe thérapeutique sont représentés en Graphique 6.
- 23 % des substances du groupe H (spécialités à base d’hormones systémiques) ont des valeurs de PDE inférieures à 1 µg/jour et sont équivalentes aux produits des classes HOI (hormones hypothalamiques, notamment l’octréotide) ou H03 (hormone thyroïdienne). 32% des substances H sont dans le groupe 4. Dans les préparations hormonales, 9% des substances ont une valeur de PDE située entre 1 et 0,1 mg/jour et 36% entre 0,1-0,01 mg /jour.
- 18% des substances du groupe G (appareil urogénital et hormones sexuelles) ont des valeurs de PDE inférieures à 1 µg/jour et elles correspondent aux hormones sexuelles de cette classe (ATC G03).
- Lorsque le groupe thérapeutique L est analysé, 25% de ces produits ont des valeurs de PDE inférieures à 1 µg/jour et elles correspondent à des agents immunosuppressifs (fingolimod) ou à des agents antinéoplastiques (mercaptopurine, docétaxel, etc.). Dans ce groupe, 13% des substances ont des valeurs de PDE supérieures à 1 mg/jour.
- Lorsque l’on examine le groupe S (organes sensoriels) on observe que 27% des substances de cette classe relèvent du groupe 5 (PDE inférieure à 1 µg/jour). Ces produits correspondent à des agents décongestifs ophtalmiques, classe S01G (notamment naphazoline), à des agents antiglaucomes, classe SOIE (latanoprost), antiallergiques ophtalmiques, classe S01G (azélastine) ou anticholinergiques ophtalmiques tels que l’atropine.
- Si nous analysons les produits du système nerveux (classe ATC N), nous constatons que seuls 7% ont des PDE inférieures à 1 µg/jour, correspondant principalement à des substances antipsychotiques telles que le bempéridol, à des dérivés de benzodiazépine (nitrazépam) ou des anesthésiants (sufentanil).
- 12% des substances du groupe R (système respiratoire) ont des valeurs de PDE inférieures à 1 µg/jour et elles correspondent à des décongestionnants ou à des agents adrénergiques en inhalation tels que le salbutamol.
Conclusion
Les propriétés spécifiques, tant pharmacologiques que toxicologiques, de chaque Substance Active doivent être dûment évaluées avant d’établir les limites d’exposition fondées sur des critères de santé pour les médicaments fabriqués dans des installations partagées selon les critères de la directive EMA/CHMP/CVMP/SWP/169430/2012. En s’appuyant sur les propriétés individuelles des Substances Actives, une étude scientifique et approfondie permet d’établir une limite d’exposition concrète en cas d’inspection par les autorités de santé et opposable en cas de contrôle des validations des méthodes de nettoyage.
Notre analyse sur 1200 monographies PDE de Substances Actives a notamment révélé qu’il n’est pas possible d’estimer la dangerosité ou la toxicité des Substances Actives a priori uniquement en fonction de leur groupe thérapeutique. Les substances ayant un niveau de toxicité élevé, voire très élevé, ne correspondent pas nécessairement aux groupes attendus, tels que ceux des hormones ou des agents cytotoxiques, et que toutes les Substances Actives de ces groupes thérapeutiques ne présentent pas de facto une exposition élevée dans les risques liées aux contaminations croisées pour les patients. Il est donc effectivement pertinent d’effectuer une évaluation toxicologique et pharmacologique individuellement pour chaque Substance Active, indépendamment du “groupe” auquel il appartient.
Partager l’article

Matthieu CHAREYRE – SOCOSUR CHEM
m.chareyre@socosur.eu

Beatriz CARRERO – AZIERTA
Bibliographie
(1) Guideline on setting health-based exposure limits for use in risk identification in the manufacture of different medicinal products in shared facilities. EMA/CHMP/ CVMP/SWP/169430/2012
(2) ISPE (2010). International Society for Pharmaceutical Engineering Baseline. Pharmaceutical Engineering Guide. Volume (7) Risk-based manufacture of Pharmaceutical Products: A Guide to managing risk associated with cross-contamination. Première édition, septembre 2010
(3) ICH Topic Q3C (R4): Impurities: Guideline for Residual Solvents (CPMP/ICH/283/95)
(4) VICH GL18(R): Impurities: Residual solvents in new veterinary medicinal products, active substances and excipients (EMA/CVMP/VICH/502/99-Rev.l)
(5) ICH Q3D: Elemental Impurities. (Sept.2015).
(6) ATC/DDD Index 2017. Access online at: https://www.whocc.no/atc ddd index/`
(7) Allan W. Ader, John P. Farris, Robert H. Ku. Occupational health categorization and compound handling practice systems— roots, application and future. Chemical Health & Safety, July/August 2005.
(8) Naumann BD, Sargent EV, Starkman BS, Fraser WJ, Becker GT, Kirk GD. Performance-based exposure control limits for pharmaceutical active ingredients. Am Ind Hyg Assoc J. 1996 Jan; 57(l):33-42.