Sommaire
- L’intérêt de la désinfection automatisée des surfaces d’un RABS par decontamination aérienne
- Utilisation d’isolateurs individuels pour la thérapie cellulaire autologue
- Calculation of greenhouse gas (GHG) emissions expressed in CO2eq of an open system (AinB) compared to a closed system equipped with isolators (AinD)
- Exigences croisées de la norme ISO 13408-2 et de l’Annexe 1
- Employing Conductivity Measurements for On-site Residue Quantification
- LEAN. Utiliser le digital pour transmettre et former vos équipes sur le terrain
- Deciphering the complex characteristics of nanomedicines
- L’industrie pharma doit réduire sa trace carbone, ... le traitement d’air. Part 2
L’intérêt de la désinfection automatisée des surfaces d’un RABS par décontamination aérienne
De nombreux sites de production pharmaceutique stérile font évoluer leurs équipements vers davantage de confinement et de sécurité, en particulier les lignes de répartition aseptique. L’élimination des interventions humaines directes au niveau des zones critiques est au cœur de la stratégie de maîtrise de la contamination. Cette tendance s’accélère avec la nouvelle version de l’Annexe I des BPFs Européennes. En effet, dès le point 2. Principe (i.) il apparaît clairement que “l’utilisation de technologies appropriées (par exemple, les systèmes barrières à accès restreint (RABS), […]) doit être envisagée pour accroître la protection du produit […]”.

Les RABS (Restricted Access Barrier System) permettent la protection du produit de la contamination potentielle amenée par l’opérateur et/ou l’environnement de remplissage, essentiellement grâce à la barrière physique statique assurée par les parois imposant une manipulation à travers des gants de la barrière utilisée en configuration close et à la barrière physique dynamique garantie par le flux unidirectionnel d’air filtré HEPA. Dès lors, cet outil paraît intéressant dans le design initial d’une zone aseptique ou le revamping d’une ligne de technologie conventionnelle.
Le contrôle de la contamination en vue du maintien des limites réglementaires des environnements classés requiert des activités de nettoyage et de désinfection rigoureuses qui présentent, notamment dans le cas des barrières technologiques, des défis liés à des éléments parfois difficilement accessibles par les techniques manuelles (comme par exemple, les bras robotisés). Le recours à des techniques de “fumigation” peut s’avérer particulièrement utile dans ces cas, plus particulièrement encore après de longs mois de travaux avec déclassification des locaux. Cet article présente les fondamentaux scientifiques de la Désinfection des Surfaces par Voie Aérienne (DSVA) Automatisée et met en exergue son intérêt industriel dans le cadre de la mise en route après travaux d’un RABS.
1. Contexte : Une mise à blanc sensible après travaux
Le cas présenté dans cette publication est celui d’une zone à atmosphère contrôlée comprenant une ligne de remplissage entourée d’un RABS dans une salle de Classe B, ainsi que ses zones adjacentes (couloir d’accès et sas B, plusieurs salles et sas de Classes C), situés dans un bâtiment existant de production de médicaments parentéraux.
Cette zone a fait l’objet de travaux de transformation sur plusieurs mois qui ont nécessité son isolement complet afin de sécuriser les zones adjacentes en activité, avec création d’un accès “chantier” via une zone technique et des mesures adéquates de mise sous contrôle de la contamination.
Dans le cadre de ces travaux, le design de la ligne de remplissage sous RABS a été totalement revu avec notamment une mise en place d’un bras robotisé, de gants supplémentaires, d’un système de convoyage vers la zone C des unités remplies et fermées (illustration 1).
Etant donné d’une part, la durée, l’ampleur des travaux, la mise en œuvre avec accès depuis la zone technique, l’installation de systèmes potentiellement plus difficiles d’accès aux opérations de nettoyages/désinfections habituelles, et d’autre part, la remise en conformité des locaux (souvent appelée “mise à blanc”) prévue lors des mois d’hiver reconnus comme étant plus humides et à risque d’un point de vue contamination par des micro-organismes type moisissures ou bactéries sporulées, la décision a été de complémenter le protocole de désinfection “manuelle” déjà largement éprouvé par un processus de bio-décontamination aérienne pour le RABS ainsi que pour l’ensemble de la zone en travaux.
Le protocole de “mise à blanc” existant après travaux comprend plusieurs étapes :
- un nettoyage renforcé avec un produit nettoyant/détergent qui a pour but d’éliminer l’ensemble des déchets, salissures, dépôts, traces au niveau du sol et des équipements.
- un nettoyage complémentaire avec un produit nettoyant/détergent avec rinçage et raclage de toutes les surfaces ainsi que de l’ensemble des équipements fixes et mobiles. L’objectif est l’élimination de toutes les particules et traces résiduelles afin de permettre d’optimiser les étapes de désinfection ultérieures.
- un run de pré-désinfection avec un agent sporicide qui permet de réduire la charge microbienne, suivie d’une phase d’aération (phase d’épuration de l’air). Après cette étape, l’ensemble des conditions de production en zone aseptique doivent être respectées (différences de pression entre salles classées, règles d’entrée, d’habillage et de gestuelle aseptique, réactivité aux alarmes, etc…).
- 3 runs de désinfection avec un agent sporicide suivis systématiquement de runs de prélèvements environnement renforcés (vérification des limites des zones au repos, ajout de points de monitoring supplémentaires ciblés sur des surfaces potentiellement plus difficiles à désinfecter).
Etant donné que la bio-décontamination aérienne du RABS et des locaux classés n’a pas été prévue lors de la conception des locaux, un protocole spécifique a été développé et approuvé pour cette opération, puis rattaché à la documentation de gestion de ce projet.

2. Quelques rappels réglementaires et définitions applicables à la désinfection ou à la bio-décontamination des RABS
Annexe 1 des BPFs Européennes :
§4.22 : Les méthodes de décontamination (nettoyage et bio-décontamination et, lorsque cela est applicable, inactivation des matières biologiques) doivent être définies et maîtrisées de manière appropriée. Le processus de nettoyage avant l’étape de bio-décontamination est essentiel ; tout résidu restant peut inhiber l’efficacité du processus de bio-décontamination.
ii. Pour les RABS : la bio-décontamination doit inclure l’application systématique d’un agent sporicide à l’aide d’une méthode validée et ayant démontré, de manière robuste, le traitement de toutes les surfaces internes afin d’assurer un environnement approprié pour le procédé aseptique.
§4.36 : Lorsque la fumigation ou la désinfection par la vapeur (par exemple, peroxyde d’hydrogène en phase vapeur) des salles propres et des surfaces associées sont utilisées, l’efficacité de tout agent de fumigation et du système de dispersion doit être maîtrisée et validée.
Plusieurs termes dans le langage courant désignent la désinfection : la DVA ou la DSVA sont l’acronyme de cette étape de Désinfection (des Surfaces) par Voie Aérienne, par opposition à la désinfection manuelle des surfaces. Il existe plusieurs technologies de DSVA, et celles-ci peuvent être passées dans le vocabulaire courant des professionnels, selon leur expérience ou leur affinité avec telle ou telle méthode : la VHP, ou VPHP, désigne la vaporisation d’H₂O₂ concentré (Vaporised Hydrogen Peroxide, ou Vapour Phase Hydrogen Peroxide), tandis que nébulisation, brumisation, voire fumigation désignent la formation à froid de brouillard de micro-gouttelettes d’H₂O₂.
La réglementation quant à elle est très précise sur les terminologies à employer : l’Annexe 1 rappelle bien la différence entre désinfection, biodécontamination et décontamination (glossaire de l’Annexe 1 des BPF, version française du 18/06/2024).
Bio-décontamination : Processus qui élimine les micro-organismes viables par l’utilisation de sporicide chimique.
Décontamination : Processus global d’élimination ou de réduction de tout contaminant (chimiques, déchets, résidus ou micro-organismes) d’une zone, d’un objet ou d’une personne. La méthode de décontamination utilisée (par exemple, nettoyage, désinfection, stérilisation) doit être choisie et validée afin d’atteindre un niveau de propreté approprié à l’utilisation prévue de l’élément décontaminé.
Désinfection : Processus par lequel la réduction du nombre de micro-organismes est obtenue par l’action irréversible d’un produit sur leur structure ou leur métabolisme, à un niveau jugé approprié à un usage ou une finalité définie.
Nous parlons donc bien ici de désinfection ou de bio-décontamination : l’objectif est de réduire le nombre, voire d’éliminer les micro-organismes des surfaces en zone classée.
3. Matériel et méthode
Le cahier des charges pour cette DSVA est le suivant :
- Biocide non corrosif pour le matériel neuf, électronique et sensible
- Biocide faiblement concentré et manipulations maîtrisées, pour la sécurité des opérateurs
- Facilité de mise en œuvre, intégration de cette opération entre les étapes du processus habituel
- Efficacité de la désinfection sur l’ensemble du bâti machine, du bras robotisé, et de la pièce autour.
La technologie de centrifugation Devea (Micro-Drop technology) est une technologie unique en DSVA, brevetée, qui diffuse un brouillard de micro-gouttelettes de biocide (voir illustration 1). La répartition particulièrement homogène du brouillard permet d’utiliser un biocide plus faiblement concentré, tout en atteignant des résultats conformes aux attentes de l’industrie stérile (6 log10 de réduction de spores Geobacillus stearothermophilus couramment). La concentration totale en H₂O₂ au cours du traitement est relativement faible (100-120 ppm, soit cinq à sept fois moins élevée qu’avec une technologie diffusant de la vapeur chaude d’un peroxyde d’hydrogène à 35% par exemple), et n’endommage pas les matériaux de la salle propre au cours du temps, ni les équipements, même sensibles.
Le biocide choisi est l’O2SAFE7.4 : peroxyde d’hydrogène H₂O₂ à une concentration de 7.4%, ce produit désinfectant répond à la réglementation en vigueur :
- Conforme à la Réglementation européenne sur les Produits Biocides BPR 528/2012.
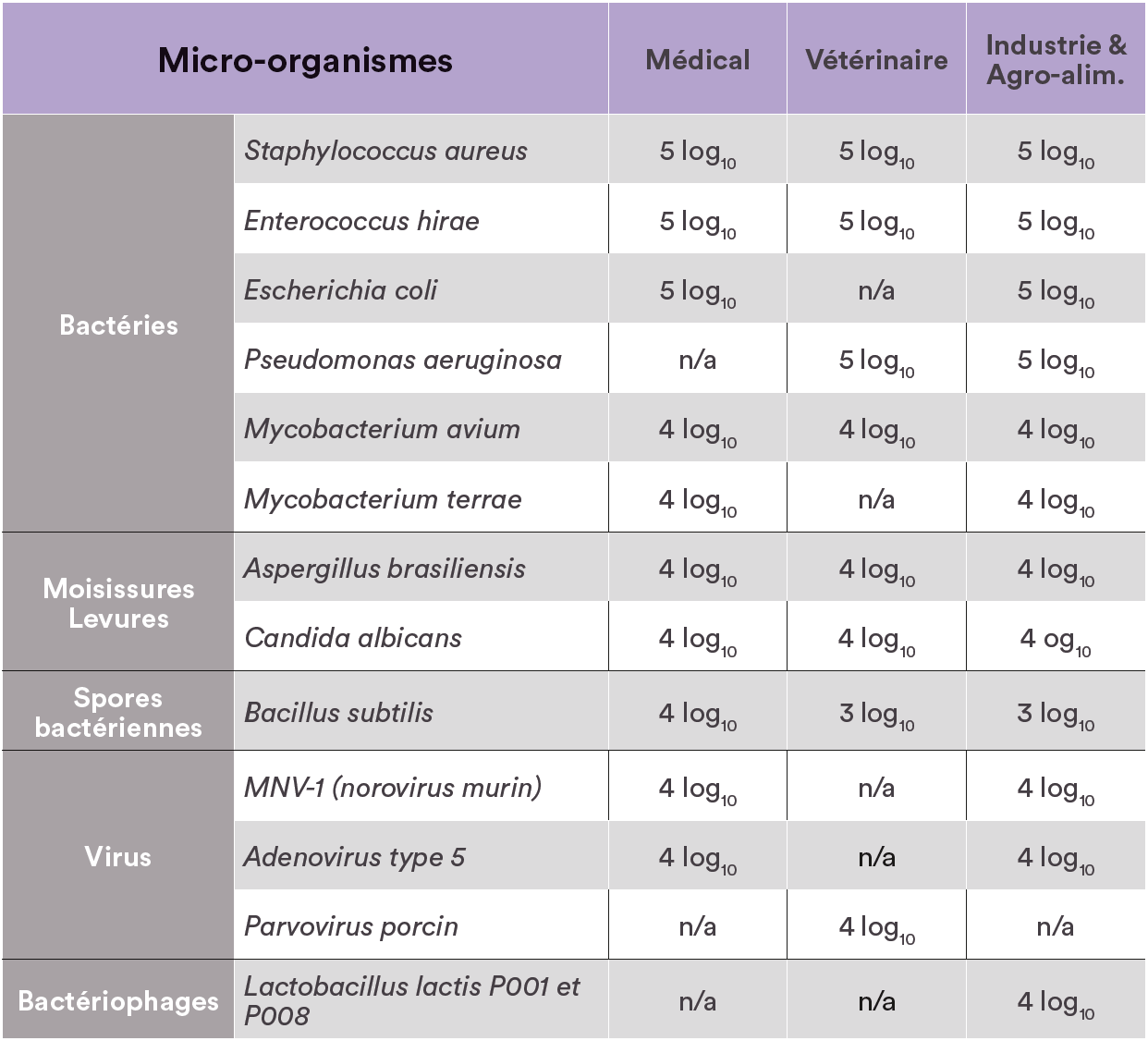
- Conforme à la norme européenne sur la DSVA par procédés automatisés EN 17-272 v2020, testé avec la technologie Phileas® : cette norme indique la méthode de détermination de l’activité biocide, et en particulier les micro-organismes sur lesquels le couple machine – produit doit être efficace, selon le secteur d’activité visé (tableau 1). Cette norme évalue en effet l’efficacité d’une solution de DSVA, et rend indissociable un équipement (méthode de diffusion du brouillard) et un produit biocide, pour l’efficacité de la bio-décontamination.
- L’ANSES en France délivre une Autorisation de Mise sur le Marché pour un produit biocide conforme aux deux réglementations européennes, pour usage en France avec l’équipement correspondant. Dans le cas de l’O2SAFE7.4®, l’AMM porte le numéro FR-2019-0071.
Le mode d’action du peroxyde d’hydrogène repose sur l’oxydation : l’H₂O₂ se décompose en H₂O+ O- lorsque les microgouttelettes se vaporisent sur les surfaces qu’elles atteignent. Ce radical d’Oxygène pénètre dans les cellules et les tue. Le peroxyde d’hydrogène est efficace contre les bactéries, les moisissures, les virus et les spores, ce qui en fait un désinfectant de choix en industrie, qui cherche un produit sporicide avant la reprise d’activité d’une zone classée.
La technologie Devea est donc sélectionnée par les opérations du site, et en particulier le modèle d’appareils petits (Phileas® 25), pouvant être placés dans un espace contraint (sur la ligne), ainsi que les appareils munis d’un capteur de poids intégré (Phileas® 75 et 250), indiquant la quantité exacte de biocide diffusé.
Le protocole est établi ensemble entre le site de Lilly et Devea, en particulier pour analyser les risques potentiels suivants :
- équipements et matériel à l’intérieur de la zone / risque d’adsorption. Tout ce qui est poreux (papier, face poreuse de sache d’autoclave, lingettes, etc.) peut adsorber du peroxyde d’hydrogène pendant la diffusion : l’efficacité à proximité de ces points peut être impactée par ce “puits” d’adsorption. Ces matériaux poreux peuvent aussi relarguer de l’H₂O₂ et pourraient retarder la réouverture et la libération de la zone.
- équipements et matériel à l’intérieur de la zone / risque d’oxydation ; l’H₂O₂ à faible concentration (en termes de concentration totale dans la zone lors du traitement, une centaine de ppm) n’est pas corrosif. Du matériel électronique peut être laissé en zone (les appareils Phileas® contiennent eux-mêmes un écran et des composants électroniques), mais certains matériaux comme le cuivre ou ses alliages sont très sensibles à l’oxydation, et devraient être protégés pour éviter des marques de surface. Les compteurs de particules ont été stockés ailleurs, les éventuelles armoires électriques doivent être discutées.
- équipements et matériel à l’intérieur de la zone / distribution du brouillard jusqu’aux extrémités de la zone ; il faut évaluer selon le positionnement de l’équipement générant le brouillard et les zones critiques, quels carters il faudra laisser ouverts pour assurer la dispersion du brouillard, et quels carters ne s’ouvrent pas ou lesquels il faut laisser fermés, pour concentrer le brouillard dans une zone critique.
- mesures Hygiène, Sécurité et Environnement (HSE). Il est nécessaire de s’accorder sur la procédure de réouverture et de libération de la zone. Quel taux d’H₂O₂ permet une entrée en zone avec ou sans équipement respiratoire ? S’agit-il d’un capteur haute ou basse concentration et où est-il situé (en zone, hors zone) ? Une (ou deux) personne(s) peu(ven)t-elle(s) entrer en zone avec masque couvrant à cartouche H₂O₂ et détecteur pour évaluer et cartographier les résidus d’H₂O₂ ?
A partir de quel taux résiduel la zone peut-elle être libérée ? L’INRS rappelle que la valeur limite d’exposition professionnelle (VLEP) ou valeur moyenne d’exposition (VME) en France est d’1ppm soit 1,4mg/ m³ (valeur mesurée ou estimée sur la durée d’un poste de travail de 8h ; Fiche Toxicologique INRS n°123). La valeur de 2 voire 3 ppm est la limite d’exposition à court terme dans certains pays (valeur STEL en Finlande, Suède, Grande-Bretagne). Enfin, le National Institute for Occupational Safety and Health (NIOSH) estime à 75ppm la valeur représentant un danger immédiat pour la personne (IDLH). Ceci pour replacer les différentes valeurs de peroxyde d’hydrogène dans leur contexte, et rappeler que le traitement de DSVA se réalise bien entendu sans présence humaine ou animale, mais également qu’il ne faut en aucun cas entrer dans une zone traitée sans détecteur ou mesure de protection appropriée.
Les bonnes pratiques de la DSVA incluent un ensemble de prérequis pour assurer les meilleures conditions pour la désinfection, dont certains sont :
- un nettoyage préalable soigneux.
Un défaut de nettoyage suivi d’une désinfection peut résulter en la formation d’un biofilm, qui pourrait s’avérer catastrophique en termes de contamination future.
En cas d’utilisation de produits chlorés, tout résidu de chlore peut former avec le peroxyde d’hydrogène (produit acide, pH autour de 3) instantanément et de manière certaine, de l’acide chlorhydrique, corrosif. Il faut rappeler ici que le peroxyde d’hydrogène à moins de 8% n’est pas corrosif en soi, mais peut réagir avec des produits chlorés.
Si ces produits chlorés sont utilisés, un rinçage extrêmement soigneux doit être mis en place.
- La température initiale doit être comprise entre 20°C et 35°C, l’hygrométrie initiale entre 30 et 70%.
4. Problématique de la mise en œuvre de la DSVA dans un RABS
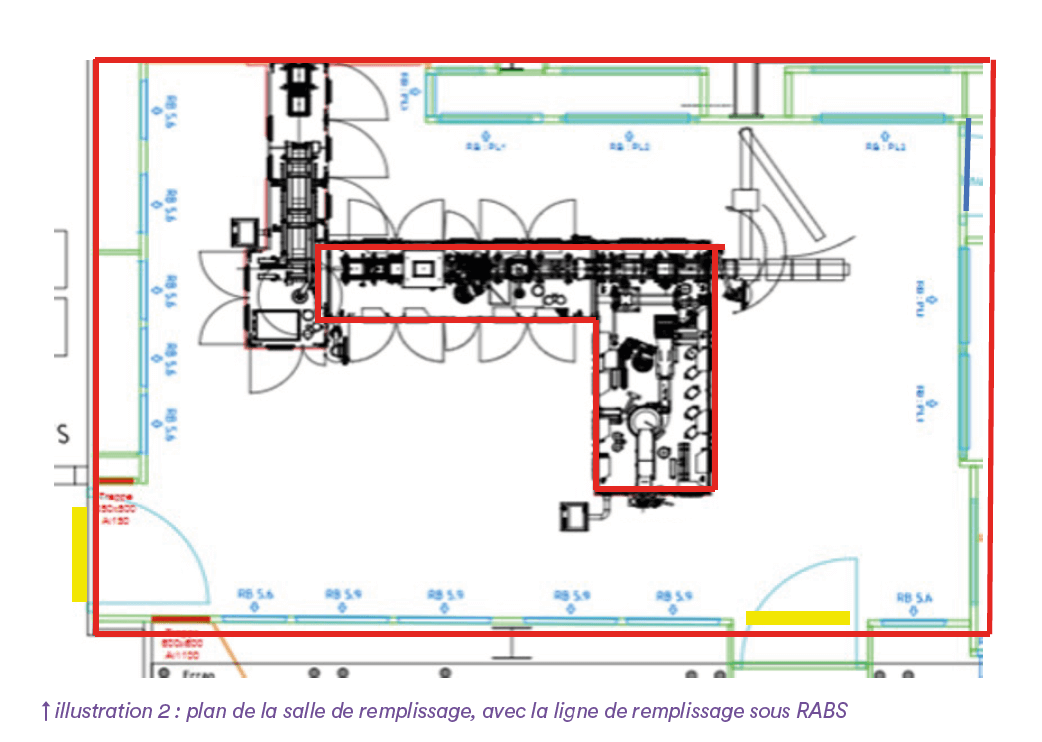
Le plan de la ligne sous RABS, dans la salle de remplissage, est présenté en illustration 2. Il s’agit d’un RABS ouvert en L, d’environ 3 mètres de longueur pour chaque partie, avec 16 gants. Le flux unidirectionnel du RABS doit être éteint pour des phases de diffusion d’H₂O₂ et de contact, de même que la Centrale de Traitement d’Air (CTA) de la zone.
Le volume intérieur du RABS est d’environ 4m³. Les différents équipements intérieurs de la ligne ajoutent des surfaces supplémentaires conséquentes, qu’il faut prendre en compte. Le point d’incertitude néanmoins, et qui est la clé de la réussite de cette DSVA, ne se situe pas dans l’estimation des surfaces supplémentaires à désinfecter, mais dans la capacité du RABS à contenir le brouillard pendant le temps de contact après diffusion du H₂O₂.
Comme le montre les illustrations 3, le bas des portes du RABS est ajouré (si l’on se projette en conditions opérationnelles normales avec des gants). Faut-il ouvrir les portes du RABS ou les garder fermées ? Peut-on désinfecter le RABS seul, ou la pièce seule, ou faut-il nécessairement brumiser les deux en même temps ? Il s’agit donc ici de trouver le programme de désinfection qui permettra de diffuser le brouillard jusqu’aux points de la ligne les plus inaccessibles, sans atteindre le point de condensation dans le RABS (ce qui rendrait le traitement inefficace), et tout en tenant compte des fuites potentielles ou des dynamiques aérauliques du brouillard.
Un développement de cycles est prévu, pour optimiser le protocole de désinfection et son efficacité ; les paramètres suivants sont modifiés :
- Nombre et positionnement des appareils Phileas®
- Volume de biocide O2SAFE 7.4® diffusé
- Temps de contact.
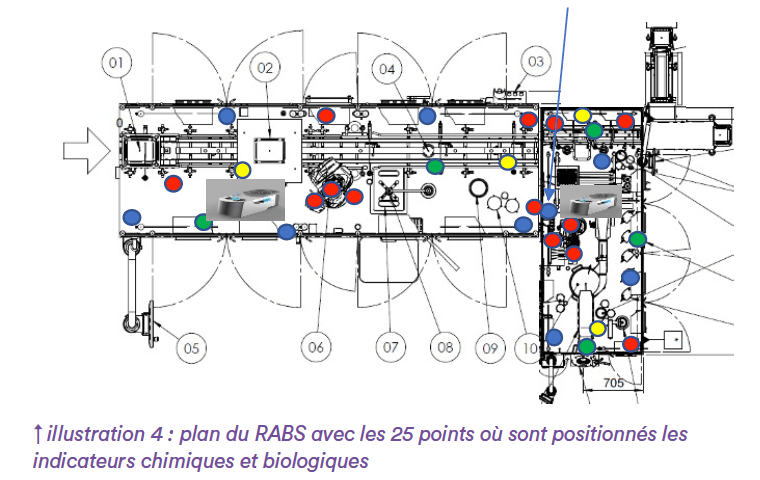
Pour évaluer l’efficacité de la diffusion et à titre informatif, lors d’une DSVA des indicateurs biologiques de Geobacillus stearothermophilus ont été positionnés en 25 points du RABS, sur la ligne comme sur les équipements (illustration 4). Des indicateurs chimiques sont également positionnés à chaque point pour valider la diffusion homogène du brouillard, ainsi que dans la salle autour du RABS : il s’agit de petites bandelettes de papier avec une zone réactive se colorant en bleu en présence d’H₂O₂ en concentration 0-100ppm.
Les indicateurs biologiques (IB ou bio-indicateurs) sont des petits coupons inox inoculés avec une population connue de la souche ATCC 12980 de Geobacillus stearothermophilus habituellement utilisés en décontamination par l’H₂O₂. Ici des coupons en Triscale (3 coupons de log10 4, 5 et 6 se trouvent dans la même enveloppe, (illustration 5) ont été préférés à des coupons de même log en triplica, pour pouvoir évaluer l’efficacité de la désinfection et détecter la nécessité d’une amélioration de protocole le cas échéant.
Après DSVA, les coupons sont récupérés et placés dans un tube de milieu de culture à incuber pendant 7 jours à la température de 55-60°C. Une population résiduelle de spores, se développant, fait virer de couleur le tube : la lecture par colorimétrie est réalisée quotidiennement pendant 7 jours.
Les critères d’acceptation définis pour cette DSVA sont :
- Indicateurs chimiques colorés en tous points
- Rapports de diffusion des équipements Phileas® conformes pour chaque zone et chaque appareil (quantité de biocide diffusée évaluée grâce à un capteur de poids situé sous le bidon de biocide)
- Pré-requis conformes et signés avant le début de la DSVA (positionnement des équipements et des indicateurs, arrêt de la CTA, conditions de température et d’hygrométrie, etc.)
Les indicateurs biologiques ont été placés ici à titre informatif, mais si la méthode devait être validée, l’objectif serait de 6log10 de réduction de spores.
5. Résultats & Discussion
Les critères d’acceptation sont atteints. Dans tous les cas, les indicateurs chimiques sont colorés, montrant une bonne diffusion du brouillard, dans le volume entier du RABS comme dans lazone adjacente. Les résultats quantitatifs des bio-indicateurs quant à eux sont conformes à une désinfection de 6 log10.
Le protocole retenu permet, en moins de 6 heures, de bio-décontaminer à 6log10 l’intégralité de l’intérieur du RABS, sur tous les points de l’illustration 4, ainsi que la pièce autour (pas d’IB posés dans la pièce). Il est rappelé qu’une validation de ce protocole nécessiterait de réaliser trois runs de DSVA consécutifs et conformes aux résultats attendus.
Le paramètre critique ici n’est pas tant le volume de biocide diffusé (sur un RABS, la différence est insignifiante) ou le temps total (pas de contrainte forte sur cette zone). En revanche, la prise en compte de la dynamique de dispersion du brouillard créé par chaque appareil et le temps de contact ont été finement étudiés. Ces performances sont tout à fait encourageantes pour l’équipe du site.
En termes de mise en œuvre opérationnelle, les premières observations de l’équipe sont les suivantes :
- Facilité de mise en œuvre : mise en place des équipements Phileas® beaucoup plus rapide que prévu, pas de matériel accessoire (ventilateur, catalyseur, etc.). Calfeutrage des ouvertures : minimes (pour les salles autant que les équipements),
- Fiabilité des diffusions : pas de bouchage des buses, diffusion égale dans le temps grâce à la centrifuga- tion,
- Sécurité : mise en route à distance grâce au système applicatif MyPhileas (audité conforme Annexe 11 et 21CFR Part11) avec un temps de retard possible (voir illustration 3, lancement par ordinateur),
- Traçabilité : rapport de diffusion de chaque appareil Phileas® téléchargé en pdf indiquant la conformité du cycle (volume de biocide diffusé par rapport au volume théorique, grâce au capteur de poids intégré).
A la fin de toute la procédure de “mise à blanc” incluant la décontamination aérienne, le monitoring environnemental (415 écouvillons & boîtes contact) n’a montré aucune colonie, aucune spore bactérienne, ni moisissure : ni dans le RABS, ni dans la salle de remplissage, ainsi que dans les salles adjacentes qui avaient également été traitées.
Une rapide évaluation des ressources, de la durée et du coût liés au protocole de “mise à blanc” après travaux tel que décrit au chapitre 1 fait apparaître, par run de désinfection, du besoin de 6 personnes pendant 10 heures pour la zone traitée, suivie d’une équipe de 3 préleveurs environnement pendant 8 heures. A ces étapes se rajoutent environ 25 heures pour le traitement des prélèvements des 3 runs au laboratoire de microbiologie.
L’objectif d’ajouter l’étape de bio-décontamination aérienne ayant été avant tout de sécuriser le retour à des conditions validées de la zone après travaux avec garantie d’atteindre les zones potentiellement difficiles d’accès à la désinfection manuelle, il n’a pas été demandé de mesurer la biocharge après les étapes de nettoyage c’est-à-dire avant cette étape de décontamination aérienne, puis après cette étape. Aussi, même s’il n’est pas possible de pouvoir estimer concrètement la contribution individuelle de cette étape de bio-décontamination aérienne, l’excellent résultat enregistré pour le protocole dans sa globalité permet néanmoins de souligner l’efficacité de l’ensemble du traitement.
La question d’une qualification de ce traitement se pose à présent de sorte à aller plus loin dans l’optimisation industrielle des opérations de “mise à blanc” avec la suppression d’un ou de plusieurs runs de désinfection manuelle réalisés habituellement en le (les) substituant par une bio-décontamination aérienne.
Une autre optimisation du recours à cette bio-décontamination sera de déterminer les conditions optimales d’aération après le traitement DSVA de sorte à raccourcir la durée avant de pouvoir réaccéder aux zones de production sans protection respiratoire individuelle.
 |  |
6. Conclusion
La méthode de désinfection automatisée avec la technologie Phileas® et O2SAFE® permet de désinfecter toutes les surfaces intérieures d’un RABS relativement chargé avec une efficacité à 6 log10 de Geobacillus stearothermophilus , ainsi que la zone adjacente au RABS.
Cette méthode est validée dans de nombreux cas d’usage, et peut être mise en regard d’une désinfection manuelle et de ses limites : problématique d’accessibilité des surfaces, durée des applications, mobilisation de nombreuses ressources, habilitation du personnel, reproductibilité liée à la variabilité, vérification de son efficacité par plans de monitoring extensifs,…
La DSVA automatisée est adoptée pour de larges applications : incubateurs, sas, isolateurs, RABS, salle, couloirs, zone entière : de 150L à 1.500m³, cette solution ‘plug-and-play’ se révèle souple et facile à mettre en œuvre ; non-corrosive et sans danger pour les opérateurs en ce qui concerne Phileas® avec l’O2SAFE®.
Les pré-requis sont limités : une température initiale entre 15 et 30°C, une humidité relative entre 30 et 75%.
La DSVA automatisée sera d’autant plus flexible que les centrales de traitement d’air salle et RABS sont séparées. Un revamping de zone ou de sas peut être une bonne opportunité pour étudier cette optimisation. Néanmoins même un design classique de ZAC permet d’y intégrer des unités mobiles ou fixes Phileas® avec un minimum d’ajustements.
L’évolution des requis réglementaires comme ceux de l’Annexe 1 des BPF Européennes et le besoin de performance industrielle vont sans doute accélérer l’intégration de méthodes telles que la bio-décontamination aérienne des surfaces dans les procédures de désinfection après travaux, après dérive ou tendance détectée au niveau des résultats de monitoring environnement voire même en routine (suite à campagne de remplissage sous RABS, ou encore pour l’introduction de matériel en zone aseptique dans des sas, etc …) dans le souci permanent de garantir la qualité des produits et de la sécurité des patients.
Références
1. Annexe 1 des BPF Européennes : Fabrication des Médicaments Stériles, version en vigueur
2. Annexe A1 de la norme EN 17 272, v2020 : Méthode de désinfection par voie aérienne par des procédés automatisés
3. Annexe 11 des BPF EU et texte US 21 CFR Part 11 :systèmes informatisés
Partager l’article