Sommaire
- Gene therapy manufacturing comes of age: Commercial-scale manufacturing is imminent. Are gene therapy innovators ready?
- Overcoming obstacles in downstream bioprocessing of AAV based gene therapy products
- Overcoming challenges in the development of lentiviral vector manufacturing platforms
- Are modern scalable bioreactors the Cell Culture Strategy needed for Gene & Cell Therapy success?
- Le pouvoir magnétique des nanoparticules triage magnétique cellulaire dépollution des milieux et nano catalyseurs réutilisables
- Développement d’une nouvelle approche préventive pour réduire les infections microbiennes avec les nanoparticules d’oxydes métalliques
- Surveillance numérique de l’environnement : détecter les défaillances avant qu’elles ne se produisent
- Maximizing Sterility Assurance: Sterile Hold Time Testing for Sterilized Items Used in Parenteral Drug Manufacturing
Le pouvoir magnétique des nanoparticules : triage magnétique cellulaire, dépollution des milieux et nanocatalyseurs réutilisables
Les nanotechnologies reposent sur la connaissance de l’infiniment petit permettant la création de nouvelles propriétés et fonctions fondamentalement innovantes. Le monde des nanoparticules représente ainsi un champ de recherche et développement multidisciplinaire avec des perspectives d’applications considérables[1][2].

Les nanoparticules sont des matériaux composés de grains dont au moins une des trois dimensions externes mesurent entre 1 et 100 nm[1]. Leur petite taille leur confère des propriétés révolutionnaires en termes de réactivité : plus leur taille est petite, plus leur surface spécifique est élevée par rapport à son volume et plus la réactivité de la surface augmente. Or, plus une particule est réactive plus son utilité en termes d’applications sera importante. Ainsi, les nanoparticules sont utilisées dans un large panel d’applications innovantes telles que l’industrie agroalimentaire, le domaine du bâtiment et des travaux publics, la cosmétique, les produits d’hygiène, l’énergie, l’environnement, les peintures, les médicaments, la plasturgie ou le textile par exemple[3]. Grâce à leurs diverses propriétés physiques et chimiques (grande surface spécifique, propriétés magnétiques…), les SPIO ou “Superparamagnetic Iron Oxide”, sont des nanoparticules d’oxyde de fer utilisées pour des applications industrielles ou biologiques, telles que la catalyse, la nanomédecine ou la dépollution. Ces nanoparticules magnétiques sont préparées par la startup SON, spécialisée dans le développement et la fabrication de nano-objets (nanoparticules avec ou sans fonctionnalisation). Elles sont ainsi biocompatibles, reproductibles et hautement caractérisées par de nombreuses techniques (Diffraction des Rayons X (DRX), Microscopie Electronique à Transmission (MET), Spectroscopie de photoélectrons X (XPS), analyse infrarouge, fluorescence X, Diffusion dynamique de la lumière (DLS), zétâmétrie, mesure de surface spécifique par BET, analyse thermogravimétrique …).
1. Le magnétisme des nanoparticules d’oxyde de fer
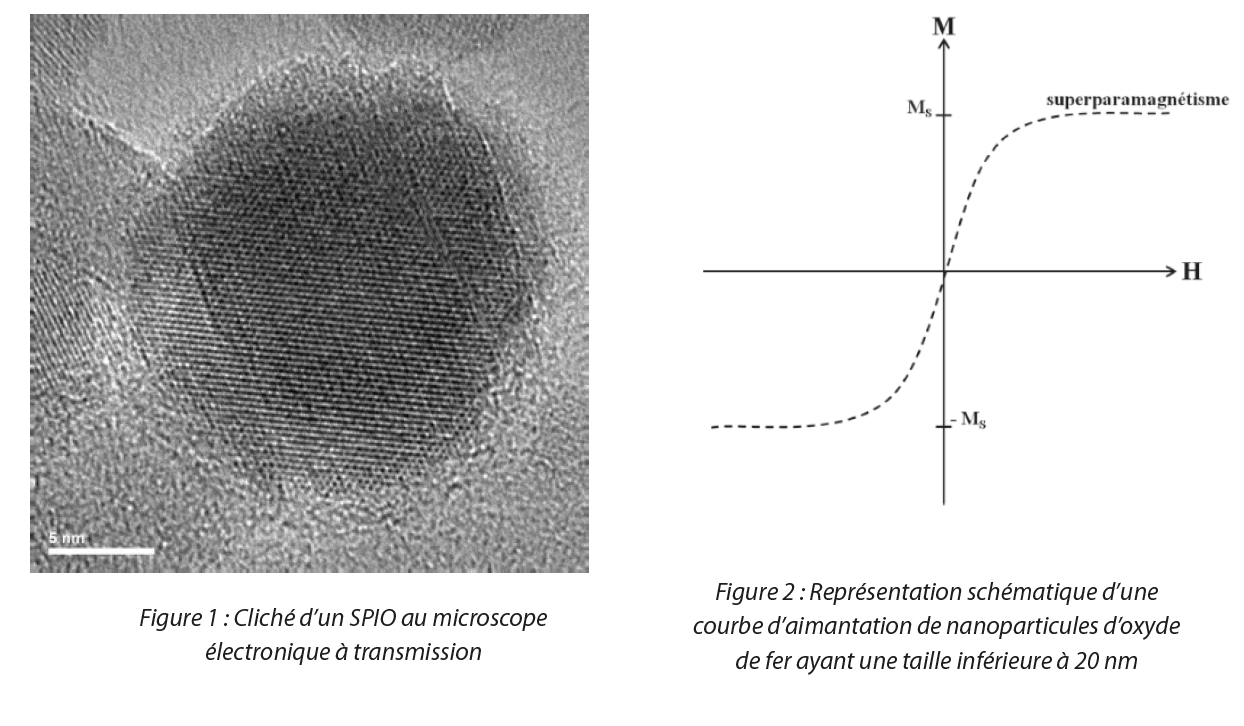
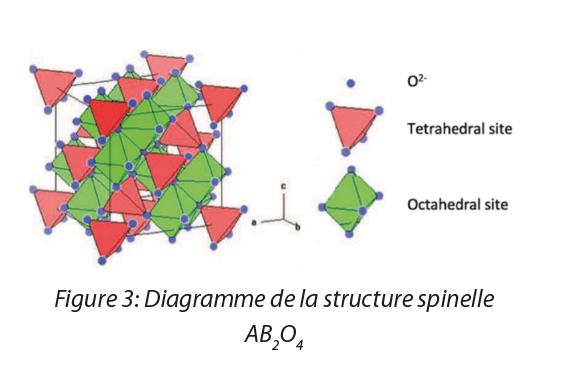
Les SPIO sont des nanoparticules d’oxyde de fer ayant des propriétés particulièrement intéressantes. Leur structure spécifique ainsi que la taille de leurs cristallites, inférieure à 20 nm (Figure 1), leurs confèrent une propriété superparamagnétique à température ambiante[4]. Autrement dit, lorsqu’un champ magnétique est appliqué, une aimantation des nanoparticules se produit. Cependant, lorsque le champ magnétique est nul, l’aimantation de ces nanoparticules disparait, comme illustré en Figure 2. De plus, plus le champ est intense, plus l’aimantation l’est également. Ce superparamagnétisme est ainsi une propriété qui peut se révéler pertinente dans certaines applications et primordiale notamment pour des applications biologiques car une aimantation rémanente (lorsque le champ magnétique est nul, l’objet conserve ses propriétés magnétiques) est responsable de l’agglomération des particules entrainant le blocage de la circulation du sang dans les vaisseaux[5].
1. La structure cristallographique des SPIO
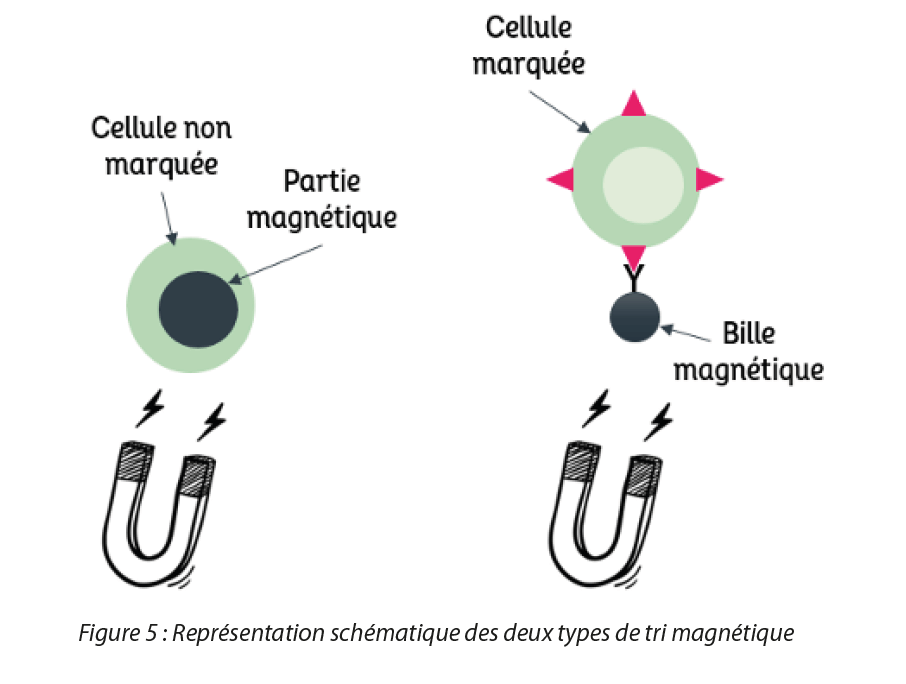
Les nanoparticules d’oxyde de fer magnétiques possèdent une structure spinelle inverse (Fe3+)A(Fe3+Fe2+)BO4 qui s’organise de la manière suivante :
• Les 32 anions O2- constituent un réseau cubique faces centrées (O) ;
• Les ions ferriques Fe3+ qui sont logés dans les sites tétraédriques (A) du réseau en occupant 8 sites tétraédriques sur 64 ;
• Les ions ferriques Fe3+, les ions ferreux Fe2+ et les lacunes qui viennent se loger dans les sites octaédriques du réseau (B) en occupant 16 sites octaédriques parmi les 32 disponibles. Deux types d’oxydes de fer possèdent une telle structure : la magnétite ((Fe3+)A(Fe3+Fe2+)BO4)) et la maghémite (obtenue par oxydation de la magnétite) ((Fe3+)A(Fe3+)BO4)). Les SPIO possèdent une structure intermédiaire entre ces deux oxydes mais tend fortement vers la magnétite. Il s’agit ainsi de cette structure particulière qui confère aux nanoparticules d’oxyde de fer ses propriétés magnétiques particulières.
2. La toxicité des nanoparticules d’oxyde de fer
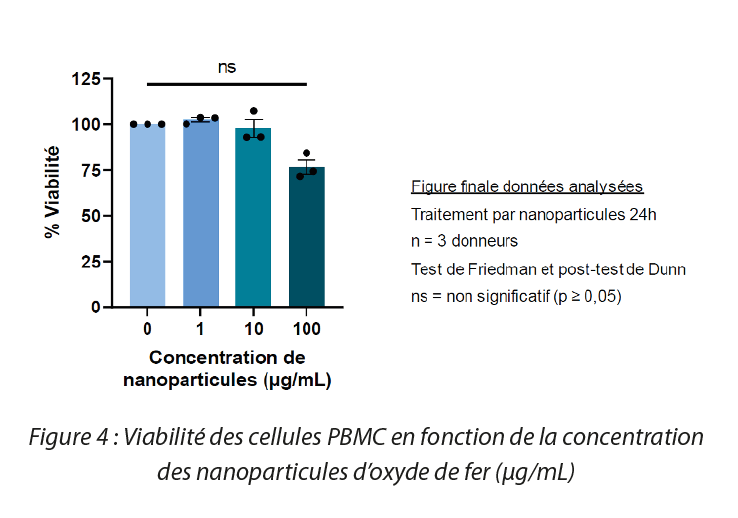
Afin d’étudier la viabilité cellulaire en présence des nanoparticules d’oxyde de fer, des cellules mononuclées du sang périphérique (PBMC) ont été traitées avec des solutions de diverses concentrations de SPIO pendant 24h à 37°C. A l’issu de ces 24h de traitement, un test MTT a été réalisé. Il a ainsi été démontré que les SPIO n’impactent pas de manière statistiquement significative la viabilité des cellules. Cependant à des concentrations plus élevées (100 μg/mL), une diminution de la viabilité est observée.
2. Quelques exemples d’applications du magnétisme des nanoparticules à travers différents domaines
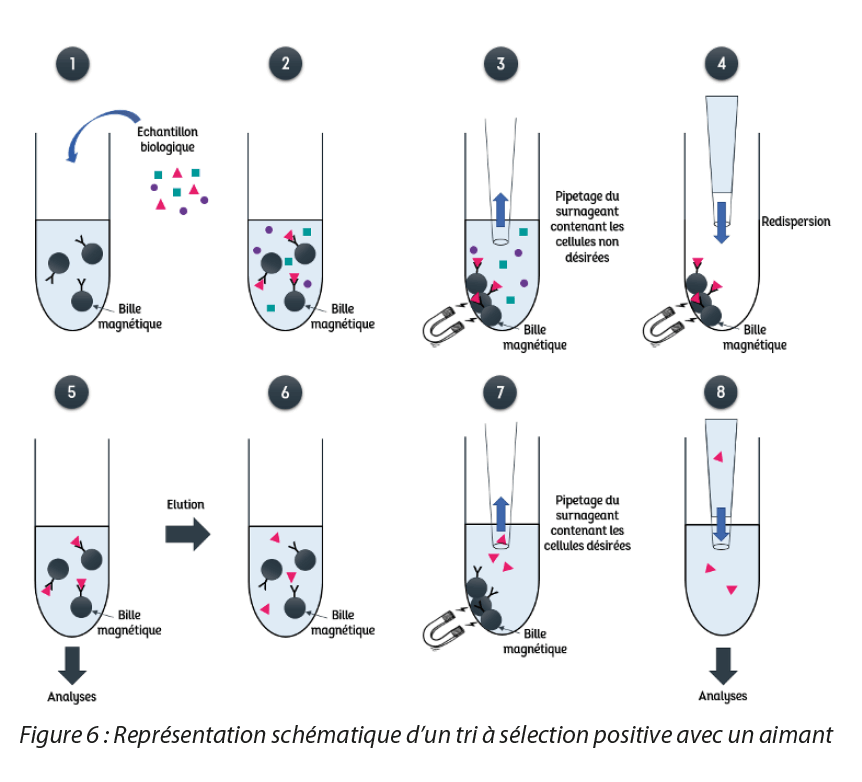
a. Triage magnétique de matériel biologique
Le tri magnétique cellulaire permet la sélection ou la suppression de différents types de composants biologiques tels que les types cellulaires, les organites intracellulaires, les protéines, ou encore les acides nucléiques par exemple. Cette technique possède de nombreux avantages tels que l’isolation de cellules directement issus d’échantillons non traités, comme le sang ou la moelle osseuse. Elle sélectionne des molécules simplement et rapidement, notamment avec l’automatisation récente de celle-ci. Comparativement au tri par cytométrie en flux, autre technique utilisée pour sélectionner des sous-populations de cellules, le tri magnétique élimine la problématique d’interférences avec les mouvements d’ions et effectue une sélection d’une population de cellules viables en grande quantité plus rapidement [6]. Il existe deux types de tri magnétique cellulaire, illustrés en Figure 3. Le premier consiste en la séparation de cellules contenant préalablement des substances magnétiques (ex : les érythrocytes qui contiennent une substance magnétique au sein de l’hémoglobine) : ces cellules peuvent ainsi être directement attirées par un aimant. Le deuxième concerne le couplage de particules magnétiques avec un ligand capable de reconnaitre spécifiquement une structure cellulaire de surface : une bille magnétique couplée à un anticorps par exemple, pourra se lier avec une cellule présentant des marqueurs spécifiques que pourra reconnaitre l’anticorps pour ainsi former un ensemble capable d’être attiré par un aimant. Ensuite, deux types de sélection sont possibles. La sélection positive consiste à récupérer de manière magnétique les cellules d’intérêt. Cependant, dans le cas du deuxième type de tri présenté ci-dessus, lorsque le ligand utilisé risque de modifier la fonction cellulaire de la cellule visée ou bien qu’il n’existe pas de ligand pour reconnaitre cette dernière, il est possible de procéder à la sélection négative : les cellules récupérées par méthode magnétique sont les cellules non désirées. Différentes méthodes sont utilisées pour effectuer le tri magnétique cellulaire, tel que le tri sur colonne [6] ou le tri qui s’effectue directement à l’aide d’un aimant. Ce dernier sera présenté dans la suite de l’article et illustré par la Figure 4 pour le cas d’une sélection positive. Tout d’abord, des particules magnétiques sont couplées à un ligand capable de reconnaitre le type cellulaire à sélectionner. Ensuite, le mélange biologique est mis en solution avec les particules magnétiques couplées (1).
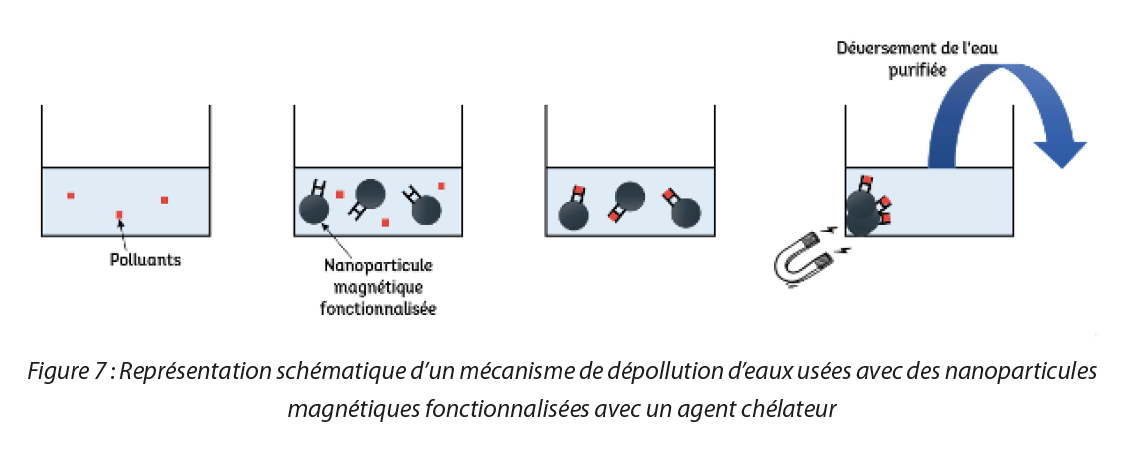
b. Dépolluer les eaux usées des métaux lourds
De nombreux métaux lourds tels que le mercure (Hg), le plomb (Pb), le cadmium (Cd), mais également, le cuivre (Cu), le nickel (Ni), le chrome (Cr), l’arsenic (As), le cobalt (Co), le zinc (Zn) ou encore le manganèse (Mn) par exemple sont rejetés continuellement dans l’environnement essentiellement par le biais des activités humaines (rejets d’usines métallurgiques, textiles ou papeteries par exemple, épandages sur les sols, incinérations de déchets ou d’essence,… ). Cependant, ces métaux lourds, qui ne sont pas biodégradables, induisent une toxicité certaine pour l’environnement et les êtres vivants. Plusieurs méthodes ont été développées afin de dépolluer les milieux. L’une d’entre elles concerne l’utilisation d’agents chélatants. Des agents chélatant ou appelé plus couramment “chélateurs” sont capables de capter des métaux lourds présents dans les eaux usées par un mécanisme de complexation. Ces chélateurs possèdent une affinité spécifique avec chaque métal. Autrement dit, chaque chélateur possède une affinité plus au moins grande pour chélater un métal en particulier. L’intérêt de greffer ces molécules à la surface d’un SPIO est de pouvoir récupérer l’ensemble des nanoparticules fonctionnalisées par des chélateurs, qui ont eux-mêmes piégé le métal à retirer, par aimantation. Ainsi, comme illustré en Figure 5, il suffit d’insérer les nanoparticules fonctionnalisées avec des chélateurs dans un milieu pollué par des métaux lourds. Ensuite, les chélateurs à la surface des nanoparticules sont capables de piéger un ou plusieurs métaux. Puis, il suffit de disposer d’un aimant afin de récupérer le tout, puisque les nanoparticules ayant un coeur d’oxyde de fer sont magnétiques. Les métaux sont ainsi récupérés en une seule opération, rapidement et facilement.
c. Des nanocatalyseurs réutilisables
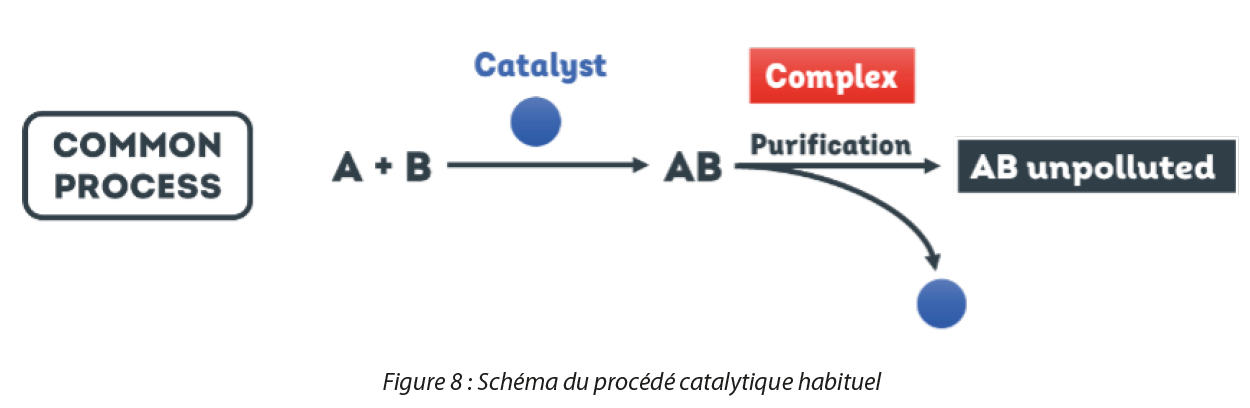
Un catalyseur est un ingrédient clé pour de nombreuses réactions chimiques. Il facilite la transformation d’une molécule en une autre molécule, sans être lui-même transformé. 90 % des transformations chimiques en milieu industriel font appel à des catalyseurs métalliques pour la synthèse de produits chimiques en grande quantité. Cependant, de nombreux catalyseurs sont fabriqués à partir de métaux précieux, ce qui les rend extrêmement coûteux et potentiellement dangereux pour l’environnement. Parallèlement, comme démontré dans la Figure 6, suite à une réaction avec un catalyseur, les industriels sont amenés à effectuer des étapes de purification lourdes énergétiquement et économiquement afin d’obtenir leur produit final. Il est également difficile dans les processus classiques de récupérer le catalyseur, ce qui soulève la problématique du recyclage et de la non-réutilisation des métaux critiques qui pourraient encore théoriquement être réengagés dans une nouvelle réaction catalytique.
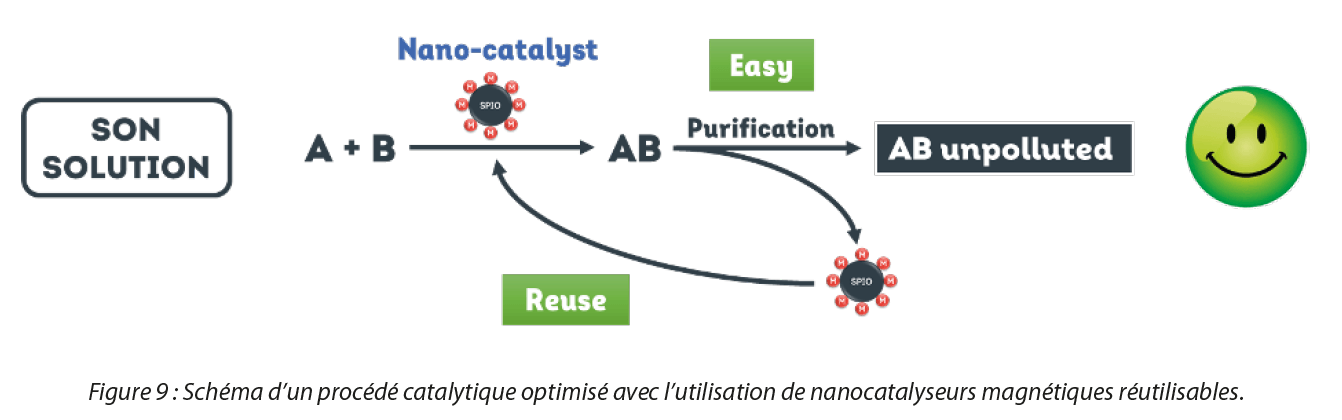
Une nouvelle solution voie le jour : des nanocatalyseurs réutilisables. La technologie de base repose sur le couplage de nanoparticules magnétiques avec, à leur surface, des métaux catalytiques comme le palladium, le ruthénium ou bien encore le rhodium, le cuivre, le nickel, l’or, le platine ou le manganèse. Les métaux sont directement accrochés à la surface, en une seule étape de synthèse et sans ligands contrairement à l’état de l’art. Grace à leur coeur magnétique, il est ainsi possible de récupérer ces nanocatalyseurs facilement par aimantation afin d’étendre leur durée de vie en les réutilisant jusqu’à 10 cycles dans un nouveau batch catalytique, comme illustré dans la Figure 7. Ainsi, en les récupérant et en les réutilisant, les industriels peuvent réduire leurs coûts de production et opter pour une chimie plus durable.
De plus, ces nouveaux nanocatalyseurs offrent d’autres avantages tels que l’obtention de meilleures performances en catalyse grâce à leur petite taille qui leur confère une surface de contact réactionnelle très large. En effet, une étude comparative des performances catalytiques entre les nanocatalyseurs de SON (ex : nanocatalyseur au Palladium) et les catalyseurs classiques ( ex : Palladium sur charbon) a été effectuée. Il a été démontré que pour une même réaction catalytique, dans des conditions similaires et avec les mêmes installations que les industriels, la quantité de métal critique utilisée (0,1% de palladium immobilisé sur les nanocatalyseurs vs. 10% de palladium dans le palladium sur charbon) ainsi que les coûts de productions (réduction de 90% des coûts) sont drastiquement réduits pour l’obtention d’un rendement plus élevé (98% avec les nanocatalyseurs vs. 70% avec le palladium sur charbon).
Cette innovation nanotechnologique permet ainsi de :
- Purifier facilement le milieu par aimantation en présence de dispositif magnétique ;
- Récupérer les nanoparticules facilement par aimantation (ou les isoler en fin de réaction dans la même cuve) ;
- Réutiliser dans un nouveau batch catalytique ; • Réaliser une catalyse très performante avec une surface de contact réactionnelle très largement supérieure à la catalyse classique ;
- Réduire considérablement les coûts de production et d’opter pour une chimie moins polluante et donc plus durable.
Ainsi, les champs d’applications des nanocatalyseurs sont vastes. Ces derniers peuvent être utilisés pour différents types de catalyses (ex : Heck, Suzuki, Sonogashira, Ullmann), mais aussi pour la déshydrogénation de l’amino-borane afin de produire de l’hydrogène[7].
 |  |
3. Conclusion
Les nanoparticules superparamagnétiques sont porteuses d’innovation dans de nombreux secteurs. Dans le domaine médical, les nanoparticules magnétiques représentent un moyen simple et rapide pour isoler une population cellulaire. Elles permettent également, en étant fonctionnalisées par des agents chélatant, de dépolluer sélectivement les milieux. Enfin, elles constituent une solution innovante permettant d’augmenter les performances en catalyses, tout en évoluant vers une chimie plus verte et plus durable en permettant la réutilisation des métaux critiques.
Glossaire
SPIO (SuperParamagnétique Iron Oxide) : nanoparticules d’oxyde de fer ayant des propriétés superparamagnétiques.
Cristallite : portion de matière qui possède la même structure qu’un monocristal c’est à dire que sa structure n’est formée que pas une seule famille de plan atomiques.
Objet superparamagnétique : objet qui présente des propriétés magnétiques lorsqu’il est placé dans un champ magnétique mais qui ne présente aucun magnétisme résiduel une fois retiré de ce champ.
Réferences
[1] Myriam RICAUD; Olivier WITSCHGER (INRS). (2012). Les nanomatériaux : Définitions, risques toxicologiques, caractérisation de l’exposition professionnelle et mesures de prévention (Edition INRS ED 6050). ISBN 978-2-7389- 20210-2. 14110 Condé-sur-Noireau: Corlet.
[2] Julien HACCOUN, Didier THERON, Aline TOURNIER. (2021). Les nanotechnologies : un nouveau paradigme, Les cahiers de l’ANR – n°5. Repéré à l’URL : https://anr.fr/fileadmin/documents/2012/Cahier-ANR-5-nanotechnologies. pdf
[3] Myriam RICAUD, Cécile OILLIC-TISSIER, Pascale BARBILLON, Catherine BRUGNOT, Christine DOLLE, Laurent FINA, Philippe LEBON, Frédéric MAITRE, Jean-Michel ODOIT (2014). Aide au repérage des nanomatériaux en entreprise (Edition ED 6174). ISBN 978-2-7389-2132-1.
[4] J.PARIS. (2015). Nanoparticules d’oxyde de fer et nanotubes de titanate pour l’imagerie multimodale et à destination de la thérapie cancéreuse. (Thèse de doctorat). Laboratoire Interdisciplinaire Carnot de Bourgogne, Université de Bourgogne, DIJON.
[5] C.J.EID (2010). Synthèse et caractérisation de nouvelles nanostructures à base d’oxyde et de carbure de Fe. (Thèse de doctorat en cotutelle). Université Claude Bernard, LYON. NNT : 2010LYO10172. Tel-00720870.
[6] F. Ghiringhelli, E. Schmitt . Tri par billes magnétiques Technique et exemple du tri des lymphocytes T régulateurs CD25+ chez le rat . Annales de Biologie Clinique. 2004;62(1):73-78.
[7] Poinsot D., Bouzid M.; Burlot A. ; Mboyi C. D. ; Doulain P. E. ; Paris J. ; Heintz O. ; Domenichini B. ; Colliere V. ; Kahn M. L. ; and Hierso J.-C.. High Recyclability Magnetic Iron Oxide‐Supported Ruthenium Nanocatalyst for H2 Release from Ammonia‐Borane Solvolysis. ChemNanoMat, 2022, 9 (8), pp.e202200285. (10.1002/cnma.202200285). (hal-03728542)
Partager l’article