Sommaire
- Les méthodes rapides en microbiologie. Une opportunité pour tout un chacun au sein de l’entreprise.
- Libération des lots de produits injectables : une affaire d’état !
- Cahier Pratique – Rationalisation des qualifications périodiques des autoclaves, des tunnels de dépyrogénation et des laveuses de flacons pour les formes injectables
- La détection des mycoplasmes par qPCR : les challenges de la mise en place de ce test en remplacement de la méthode réglementaire par culture décrite dans différentes pharmacopées (USP, EP, JP…)
- Environmental Monitoring Program: Hot topics in Microbiology & Best Practices.
- Quel est l’impact des désinfectants sur les contrôles d’environnement ?
- Current U.S.P. Perspectives on Microbial Identification
Jusqu’à tout récemment la question que nous nous posions était de savoir quelles informations nous serions prêts à sacrifier pour arriver plus vite à des résultats. Toutes les méthodes disponibles sur le marché étaient certes rapides, mais aussi destructives. Nous étions en mesure de détecter relativement vite la présence de micro-organismes, mais nous ne pouvions plus les identifier.
Ce qui peut être gênant lors de la détermination de la charge microbienne d’un produit, ou encore lors de l’utilisation de ces techniques pour un test de stérilité. À moins de dédoubler les tests, au grand dam des financiers, (un premier test pour le comptage rapide et le second pour l’identification dans l’éventualité d’une contamination), ces méthodes ne présentaient pas beaucoup d’intérêt. Sans parler de la fiabilité entre les deux répliquâts! Si l’on ajoute à cela les niveaux très bas de contamination auxquels nous somme sensés nous situer, les statistiques ne nous seraient pas favorables et les résultats de deux tests menés conjointement seraient sûrement différents.
Que veut dire “rapide” dans ce contexte ? Une réponse quasi-instantanée comme pour la technique d’identification MALDI-TOF exposée ci-dessous ne prête pas à discussion. Mais qu’en est-il des méthodes de dénombrement non destructives, qui pour la plupart, comportent une phase de croissance des microorganismes. Sommes-nous prêts à attendre, certes moitié moins de temps, mais tout de même plusieurs jours, avant d’étancher notre soif scientifique ? Nous souhaiterions pourtant laisser de moins en moins de place à la subjectivité liée à cette science, que ce soit lors des comptages, de l’aspect des colonies, de l’interprétation des colorations de Gram ou des virages d’indicateurs colorés. Cet article ne se veut ni limitatif, ni exhaustif, son seul but est de partager une longue expérience dans le domaine de la microbiologie qu’elle soit traditionnelle ou rapide.
Le point de vue réglementaire
Les industriels sont encore très prudents quant à l’usage de méthodes rapides, ils ne se sentent que peu encouragés par les pharmacopées qui insistent pourtant sur leur utilisation, mais en des termes encore timides, proposant l’introduction de ces nouvelles technologies lors “d’intervention corrective proactive” ou en vue de “l’amélioration significative de la qualité des contrôles”. Certaines d’entre elles proposent même un guide pour nous aider à choisir une méthode alternative en complément ou en remplacement d’approches conventionnelles.
Un enthousiasme partagé ne pourrait qu’être profitable au développement de ces méthodes rapides. La comparaison avec les techniques traditionnelles que nous maitrisons reste la règle, même si nous reconnaissons tous des performances supérieures aux nouvelles technologies. Que ce soit pour la détermination de présence ou d’absence de microorganismes ou pour leur dénombrement, les critères de vérification, incontournables et indispensables à raison, s’alignent sur ceux de nos collègues chimistes (exactitude, fidélité, spécificité, limite de détection et/ou de quantification, robustesse, linéarité et intervalle de mesure). Ce qui représente, pour certains de nos confrères biologistes, plus ou moins réfractaires au changement dans ce domaine, un défi apparemment insurmontable, mais qui l’est parfaitement, si l’on pense aux bénéfices tant d’un point de vue qualitatif et quantitatif, que nous apporte le confort de disposer d’une méthode rapide validée en bonne et due forme, répondant, de surcroît, pleinement aux exigences réglementaires très précises mentionnées dans les pharmacopées. (Pharmacopée Européenne : 5.6.1 Méthodes alternatives pour le contrôle de la qualité microbiologique. – U.S.P. <1223> Validation of alternative microbiological methods.) Nous pouvons de surcroît compter sur la compétence, l’implication, l’aide et le soutien total des fabricants d’équipements de microbiologie rapide dont la proactivité nous a conduits à la situation actuelle, à savoir : disposer de résultats microbiologiques plus rapidement et de façon plus fiable que par le passé.
Les techniques
1. Les méthodes de dénombrement
En ce qui concerne les méthodes qualitatives de présence/absence de microorganismes, la difficulté d’établir une relation précise, pour un faible nombre de microorganismes, entre des unités relatives de lumière et le nombre de microorganismes présents en font de parfaits candidats aux validations de méthodes alternatives.
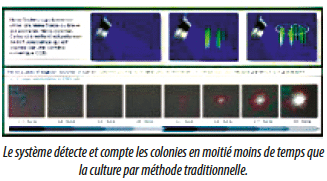
Pour les méthodes de dénombrement quantitatif, les entreprises mettant sur le marché des équipements de microbiologie rapide préfèrent rester proches des pharmacopées pour éviter de voir leurs méthodes classées comme méthodes alternatives. De ce fait, ces méthodes dites rapides sont de plus en plus basées sur la détection, par des artefacts physiques et optiques, de micro colonies visibles grâce à la technologie bien avant que notre oeil soit capable de les détecter. Dans ce dernier cas, une validation plus traditionnelle, dont nous maitrisons tous parfaitement le principe et qui facilite le changement, s’applique. Dans le domaine du dénombrement, la référence reste -à tort probablement et l’avenir nous le dira- la méthode classique du comptage des colonies sur une gélose, à l’oeil humain.
Si on la compare à l’oeil humain, les méthodes rapides permettent de réduire de moitié le temps de détection des microorganismes.
L’utilisation de milieux de culture traditionnels (U.S.P./PE/JP), l’absence d’ajout de réactifs et le dénombrement effectif en CFU (colonies formant unité) font de ces équipements des compteurs de colonies automatisables ou automatisés.
L’automatisation de cette technologie a permis à une entreprise spécialisée en microbiologie rapide de mettre récemment sur le marché un équipement basé sur ce principe. Il permet de réaliser à la fois des tests de dénombrement de microorganismes (ou test bioburden pour le contrôle de l’eau ou des solutions pharmaceutiques avant filtration stérilisante) à l’aide de milieux adaptés (TSA, R2A, SDA etc.), de contrôle de l’environnement de production (TSA avec lécithine te tween etc.) et des tests de stérilité qui pourraient intéresser bien des unités de production parentérale soumises à ces contrôles réglementaires.
Ces méthodes représentent une avancée certaine, tant du point de vue de la qualité, de la réduction des coûts de stockage que des délais de mise sur le marché. Elle permet également le contrôle de produits pharmaceutiques à courte durée de vie pour lesquels un contrôle de stérilité d’une durée minimale de 14 jours n’était pas envisageable.
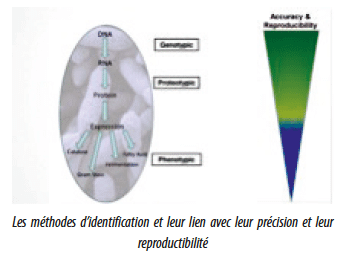
2. Les méthodes d’identification
Dans ce domaine également, outre les méthodes phénotypiques, le choix reste relativement limité. La méthode de référence (bien que discutable et discutée) reste le séquençage de l’ADN (“Gold standard”). Cette technique est réputée être la plus fiable, la plus précise et la plus reproductible, mais reste indéniablement la plus onéreuse. Sa mise en oeuvre nécessite non seulement des analystes expérimentés, mais également des spécialistes en classification phylogénétique pour les organismes présentant un résultat brut non reportable, ce qui dans nos industries ne représente pas moins de 20% des cas lors de la surveillance des environnements de production. On rajoutera à cela les coûts importants de matériels, de réactifs et de main d’oeuvre. Si dans bien des cas, l’identification au genre et à l’espèce nous permet de mener des investigations approfondies lors d’incidents de production, elle se résume souvent en des recommandations de nettoyage approfondi des zones dans lesquelles ces microorganismes ont été retrouvés. Ce dernier point, petit luxe que l’on peut s’offrir en période de vaches grasses, est rapidement remis en question dans le contexte actuel. Sorti de cette petite note d’humour, il est certainement très important, pour des environnements de production, a fortiori parentérale, de bien connaître la flore présente au genre et à l’espèce afin de pouvoir l’éradiquer ou tout au moins la maîtriser. Des techniques rapides, nous permettent d’obtenir ces résultats tout en faisant de substantielles économies par rapport à la méthode de référence, sans avoir à sacrifier d’importantes informations pour cette application.
La mise en place de ces méthodes d’identification est déjà bien avancée car il y a peu de brides règlementaires en la matière, en tout cas pas de contraintes complémentaires par rapport aux méthodes phénotypiques que nous utilisions jusqu’ici.
La méthode protéotypique MALDI-TOF (Matrix Assisted Laser Desorption/Ionisation – Time Of Flight) est l’une de ces méthodes qui permet l’obtention d’identifications de haute qualité à moindre coût.
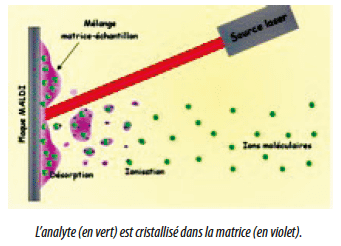
Elle fait appel à la spectrophotométrie de masse. Extrêmement simple à mettre en oeuvre, celle-ci ne demandera que quelques minutes à un opérateur formé et quelques euros au laboratoire, pour obtenir un spectre de protéines qui sera comparé à une base de données validée.
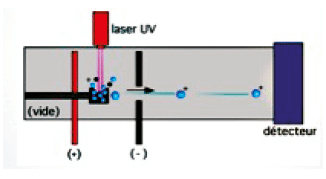
Une fraction de colonie à identifier est placée sur une plaque puis mélangée au réactif (matrice). Le dépôt (ou spot) formé est appelé cible. Une source laser est dirigée sur la cible afin d’ioniser les molécules de l’échantillon. Les ions peuvent être chargés positivement ou négativement selon leur nature. Les protéines et peptides ont des groupements accepteurs de protons et sont ionisés positivement. Les ions sont ensuite détectés en mesurant le temps que mettent les différentes particules à atteindre le détecteur. La vitesse de chaque particule dépend du rapport masse/charge. Les molécules plus grandes mettront plus de temps à atteindre le détecteur, tandis que les molécules plus petites arriveront plus vite.
Une fois l’ion arrivé au détecteur, le signal est amplifié et envoyé à un ordinateur qui traite les données et restitue les résultats sous forme de spectre. Les données enregistrées sont calculées afin de transposer les résultats dans un spectre où chaque pic correspond à un type de molécule.
L’équipement intègre les différents pics enregistrés et recherche l’identification du germe correspondant dans la base de données de référence des microorganismes.
C’est au niveau de cette base de données qu’il est important de se positionner. Quel que soit le fabriquant du spectrophotomètre de masse (ils sont 2 à se partager le marché), il conviendra de bien choisir cette base de référence de microorganismes (3 industriels majeurs les commercialisent). Certaines de ces bases commercialisées sont orientées vers le “clinique” et sont essentiellement sollicitées par les laboratoires hospitaliers et d’analyses biologiques pour identifier les microorganismes responsables de pathologies humaines. D’autres bases à dominante “industrie” permettront aux unités de productions pharmaceutiques et autres de suivre de façon précise l’évolution de leur flore dans les environnements de production. On portera également attention à la taille de la base de microorganismes de référence. On comprendra aisément que plus une bibliothèque de référence comportera de microorganismes, plus les chances d’identifier un microorganisme inconnu sera grande. Quelle que soit la technique utilisée -phénotypique, génotypique ou protéotypique- l’évolution des microorganismes et de leur classification étant permanente, il faudra régulièrement mettre à jour sa bibliothèque de référence (1x par an au vu de l’évolution actuelle de cette science), ce qui entraine bien sûr sa revalidation. Pour effectuer ce travail fastidieux, un des grands laboratoires spécialisé dans cette technique et disposant de la plus grande base de référence dans le domaine de l’industrie propose une comparaison des spectres obtenus, non pas à une base de données interne à votre laboratoire, mais à ses propres bases de données, régulièrement mises à jour et validées, de façon à vous dispenser de ce travail fastidieux.
Mais quel que soit votre choix de matériel et de fournisseur, cette méthode rapide vous permettra d’identifier les microorganismes non pas en 2 jours, ni même en 1 jour comme pour la méthode génotypique de référence, mais en quelques minutes, vous permettant ainsi d’améliorer votre réactivité face à une tendance ou une investigation portant sur des microorganismes.
3. Le test de recherche des endotoxines bactériennes
Parce qu’il existe depuis plusieurs années une variante rapide de cet essai (résultat en 15 min.) qui permet de gagner du temps par rapport à la méthode traditionnelle (résultat en 1h au mieux), et qui de surcroît ne détecte pas de microorganismes, mais leurs résidus au moment de leur lyse (endotoxines bactériennes), le test LAL est souvent oublié quand on mentionne les méthodes rapides.
Une fois le point de la viabilité des limules écarté (*), la problématique de ce test reste la même que pour les méthodes proprement microbiologiques. Premièrement, sommesnous prêts à utiliser une méthode alternative (facteur recombinant C) avec sa multitude de critères à valider (voir§2.) ou préférons-nous suivre une approche plus conservatrice et nous limiter à la vérification de la méthode pharmacopée LAL (méthode et variantes du Lysat d’Amebocytes de Limules)?
Deuxièmement, souhaitons-nous mettre en place une méthode automatisée ou automatisable ?
Ce qu’il faut savoir, c’est qu’il existe à l’heure actuelle un système de cartouches précalibrées, faisant appel à des gammes archivées, ne nécessitant pas de réaliser de gammes d’étalonnage et pouvant fournir un résultat en moins de 15 minutes.
Cette avancée peut servir les laboratoires ne réalisant que peu de tests. Pour les plus gros “consommateurs”, la question de l’automatisation de la méthode pharmacopée ou de la méthode alternative devra être évaluée au cas par cas, sachant que la seule méthode automatisée commercialisée (“clés en main”) actuellement est susceptible d’entrainer une réduction les frais de main d’oeuvre plus ou moins équivalente à l’augmentation des frais de consommables. Et c’est ce constat qui nous mènera au point suivant.
La mutation d’une profession
Si les méthodes rapides comme les techniques d’identification sont une manne pour les financiers, elles n’en restent pas moins source d’appréhension.
Appréhension, pour les investisseurs, qui n’ont à ce jour que peu de recul, leur utilisation étant encore limitée.
Appréhension, pour les décideurs, qui seront les boucs émissaires au moindre petit défaut de jeunesse de ces techniques et les victimes de leur ouverture d’esprit concernant les technologies de l’avenir.
Appréhension, pour les analystes surtout, qui se voient déchargés de plus de la moitié de leur temps de travail, quelle que soit la méthode évoquée.
Ces méthodes sont destinées à “dégager du temps qu’ils pourront passer à des activités plus gratifiantes” aux dires de leurs promoteurs. Et s’il est vrai que ces méthodes, pour la plupart automatisables, prennent en charge les taches routinières et parfois bien ingrates, il suffira d’un rapide exercice de remue-méninges pour en dégager les opportunités bien réelles qu’elles offrent aux techniciens de laboratoire.
Pour combler nos attentes les équipements devront être utilisés par des techniciens ayant une parfaite connaissance de leur fonctionnement et de leurs possibilités. Ces équipements ramèneront à coup sûr, leur lot de nouveaux petits problèmes à résoudre. L’évolution du métier se fera vers ces postes qui demandent bien plus de prises de décision que d’exécution. Les plus créatifs d’entre nous utiliseront leurs connaissances pour appliquer d’autres méthodes existantes au labo à ces nouveaux équipements (comptages, tests AET, tests de fertilité etc.).
Et c’est libérés des suspicions d’erreurs de dilutions ou de contaminations par l’analyste, toujours faciles mais encore trop souvent mises en avant, libérés de la frustration de ne pouvoir suivre jusqu’au bout les investigations résultant de leurs travaux par manque de temps, qu’ils pourront se projeter dans l’avenir. Plus de problème d’intégrité de données brutes non plus. Cette adaptation nécessitera la participation de tous les acteurs (RH, encadrement, techniciens …) afin de surmonter cette peur de l’innovation et d’acquérir l’ouverture d’esprit nécessaire pour affronter le monde professionnel de demain.

Guy ROEHRIG – LILLY
guyr@lilly.com
Partager l’article
Références
(*) Atlantic States Marine Fisheries Commission Stock Assessments. http://www.asmfc.org/uploads/file//52a88db82013HSC_StockAssessmentUpdate.pdf
South Carolina Department of Natural Ressources, Marine Ressources Research Institute.
www.dnr.sc.gov/marine/mrri/SEAMAP/seamap.html