Sommaire
- L’intérêt de la désinfection automatisée des surfaces d’un RABS par decontamination aérienne
- Utilisation d’isolateurs individuels pour la thérapie cellulaire autologue
- Calculation of greenhouse gas (GHG) emissions expressed in CO2eq of an open system (AinB) compared to a closed system equipped with isolators (AinD)
- Exigences croisées de la norme ISO 13408-2 et de l’Annexe 1
- Employing Conductivity Measurements for On-site Residue Quantification
- LEAN. Utiliser le digital pour transmettre et former vos équipes sur le terrain
- Deciphering the complex characteristics of nanomedicines
- L’industrie pharma doit réduire sa trace carbone, ... le traitement d’air. Part 2
Utilisation d’isolateurs individuels pour la thérapie cellulaire autologue
La thérapie cellulaire autologue est un des modèles de thérapie en cas de désordre cellulaire avec un prélèvement sanguin individuel, une séparation et une modification des cellules avant d’injecter au patient qui est le donneur des cellules restaurées. Les détails du processus de travail à suivre ont été décrits par l’ISPE(1). Les progrès récents avec CAR-T et CRISPR ont permis par la technologie une séparation entre les bonnes et mauvaises parties des cellules. L’environnement dans lequel ces manipulations doivent être effectuées doit respecter les Bonnes pratiques de fabrication (cGMP). Cela signifie qu’au-delà de la recherche et du développement, il doit y avoir une logique de production réalisée dans un environnement répondant aux règlementations en vigueur du pays concerné(2-3).

1. Environnement de production
Les opérations de production pour la thérapie cellulaire doivent être réalisées en conditions aseptiques et donc dans des conditions environnementales maitrisées.
Il existe deux choix d’environnement pour isoler un procédé biopharmaceutique aseptique de son environnement immédiat :
- Le procédé est réalisé dans un environnement non clos et dans ce cas une classe A sous flux dans un environnement classe B est requis. Les opérations seront réalisées sous un flux laminaire de classe A ou dans un RABS.
- Le procédé est réalisé dans un environnement clos via l’utilisation d’un isolateur clos. Dans ce cas, une classe A sous isolateur est requise et l’isolateur peut être installé dans un environnement de classe C ou D.
Ces classes A, B, C et D ne signifient pas seulement une ventilation/filtration définie, une vitesse d’air et un renouvellement de l’air filtré mais un habillage spécifique pour le personnel avec des temps d’habillage. Pour le confort de l’opérateur et l’efficacité du personnel/processus de ségrégation, le choix d’un isolateur clos dans un environnement de classe C ou D facilite la mise en œuvre du procédé(4).
2. Les différents systèmes d’isolateurs
Un isolateur intégré pour la thérapie cellulaire avec un système RTP (Rapid Transfer Port) pour le transfert des composants, incubateur et centrifugeuse a été présenté en 2016(5). Ce type d’équipement est parfaitement adapté à la recherche et au développement de séquences qui seront ensuite appliquées dans la routine quotidienne.
En cas de traitements individuels par thérapie cellulaire (CT), chaque procédé individuel doit être séparé et autonome.
Une solution est l’utilisation d’un mini-isolateur flexible individuel, qui est une variante de ce qui a été fait à l’INRA (Institut national français pour la recherche agronomique) dans l’étude du microbiome chez les souris monoxéniques. Pour garder le procédé individuel séparé des isolateurs souples et stériles, simples et prêts à l’emploi et Gamma stérilisés sont maintenant proposés par différents fournisseurs.
Ces isolateurs clos ont été décrits et utilisés depuis la fin des années 1940 en chirurgie stérile(6) et dans l’élevage de rongeurs “germ-free” en laboratoire.
En effet, des mini-isolateurs à usage unique, transparent et flexible à pression positive d’un volume approximatif de 150 litres avec manipulation par les avant-bras et ports RTP Beta existent. Ces systèmes permettent également de connecter un microscope ou caméra à la porte d’entrée Alpha.
Tout le matériel à introduire dans la classe C sont munis d’un code barre ou équivalent, stérilisés et emballés en double sache avant de passer dans une chambre de bio décontamination H2O2 après avoir retiré le premier emballage. Les cellules vivantes, très souvent congelées, provenant de l’extérieur de la classe C peuvent être entrées dans l’isolateur classe A via un système rapide RTP type Alpha/Beta adapté à la porte d’entrée de l’isolateur et au poste de travail pour les cellules.
3. Fonctionnement des isolateurs
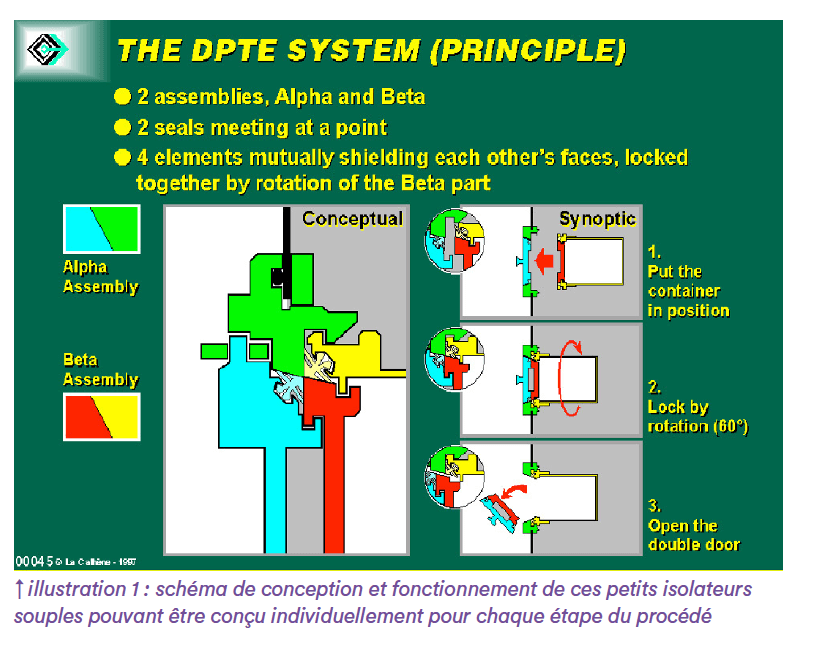
L’illustration 1 représente un schéma de conception et fonctionnement de ces petits isolateurs souples pouvant être conçu individuellement pour chaque étape du procédé.
Le système de ventilation/filtration de chacun de ces isolateurs est composé d’un filtre à membrane hydrophobe d’entrée 0,5 micron et d’un filtre HEPA de sortie. Le gaz utilisé pour gonfler l’isolateur peut être soit de l’air comprimé ordinaire, soit une combinaison de gaz comprimé pour augmenter le développement des cellules (ajout de CO2 par exemple). La pression positive est comprise entre 30 et 50 Pa. L’isolateur de stockage et l’isolateur de service sont tous deux équipés d’une filtration unidirectionnelle par ventilation à flux/HEPA pour éliminer le plus rapidement possible toute trace de H2O2 pendant la phase de bio décontamination après aération du VPHP.
Le point clé de cette configuration est l’utilisation des systèmes RTP alpha/bêta pour divers chargements et déchargements sans risque de contamination croisée par des particules viables et non viables. Ce type de raccordement avec rotation est contrôlé par leurs fournisseurs pour la qualité des joints et la sécurité des connexions multiples(6).
Le point principal de cette installation est l’utilisation unique des isolateurs individuels depuis la leukaphérèse jusqu’à l’injection finale au patient, y compris la phase microscope/caméra comme décrit dans(4a). La contamination à l’intérieur de l’isolateur est exclue grâce aux transferts via des connexions aseptiques type CPC et RTP. Les systèmes fermés restent clos pendant toute l’opération garantissant toute contamination croisée avec l’environnement.
4. Applications possibles
La plupart des étapes du process peuvent être réalisées dans ces petits isolateurs autonomes. Les cellules sont transférées directement depuis l’extérieur via le système de transfert. Dans le cas de cellules congelées à moins 70°C, un manchon isolé du système de transfert peut être trempé dans un bain d’eau pour l’étape de décongélation. Les conteneurs stériles prêts à l’emploi type MW RTP peuvent être utilisés comme rotors de centrifugation. L’incubation peut être effectuée dans une salle d’incubation à 35°C, en tant qu’élément de la salle blanche C ou D ou dans un conteneur MW RTP qui doit être placé dans un incubateur approprié.
L’isolateur de stockage maintient les composants nécessaires stériles et l’isolateur de service permet le transfert vers le module de fabrication via des ports RTP verticaux (cuvettes centrifuges) et horizontaux (composants).
5. Conclusion
Ces isolateurs souples type “ballroom” dont la conception sera adaptée à chaque étape du procédé apportent un confort d’utilisation par le personnel et une sécurité maximale pour le procédé de fabrication tout en limitant l’investissement et les dépenses d’installation et de qualifications.
Un ensemble de technologies connues, maitrisées et normalisées (isolateur, microfiltration, filtration HEPA, VPHP, RTP, SUT et Gamma stérilisation) permet, conformément à l’Annexe 1 révisée de l’EMA 2022, de procéder à des protocoles individuels stricts stériles pour la thérapie autologue CAR-T pour les tumeurs solides.
Références
1. https://ispe.org/pharmaceutical-engineering/november-december-2020/flexible-facility-design-multiple-cell-therapy
2. Administration américaine des aliments et des médicaments. “Approved Cellular and Gene Therapy Products” 29 mars 2019. https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/approved-cellular-and-gene-therapy-products
3. Agence européenne des médicaments. “Advanced Therapy Medicinal Products: Overview” 23 juillet 2020. https://www.ema.europa.eu/en/humanregulatory/overview/advanced-therapy-medicinal-products-overview
4.a Points à prendre en considération pour le traitement aseptique des produits pharmaceutiques stériles dans les isolateurs 2020 Parenteral Drug Association, Inc.
4.b Administration des aliments et médicaments des États-Unis. Guide pour l’industrie des produits pharmaceutiques stériles fabriqués par traitement aseptique. Bonnes pratiques de fabrication actuelles, ministère américain de la Santé et des Services sociaux. Rockville, MD, 2004
4.c Eudralex, The Rules Governing Medicinal Products in the European Union: Volume 4, EU Guidelines to Good Manufacturing Practices for Medicinal Products for Human and Veterinary Use-Annex 1, Manufacture of Sterile Medicinal Products ; Commission européenne 2008. http://ec.europa.eu/health/files/eudralex/vol-4/2008_11_25_gmp-an1_en.pdf(consulté le 19 novembre 2014)
5. Une histoire de la technologie des isolateurs et des dispositifs de confinemen. Partie 1- Le confinement précoce mène aux films isolants flexibles par Doug Thorogood Clean Air and Containment Review | Issue 18 | April 2014
6. Aborder les questions clés dans la mise en œuvre réussie des thérapies cellulaires à l’échelle commerciale : une étude de cas réelle par Marco Fadda & Massimiliano Cesarini à ISPE 2019 Europe Biotechnology. Conference 25-26 septembre Bruxelles Belgique
Partager l’article