Sommaire
- ASTM E2500 : let's cross the Bridge !
- De l'étude du contexte à l'emploi de technologies de traitement des eaux adaptées
- Une nouvelle stratégie de gestion de l'eau en industrie pharmaceutique
- Cahier Pratique - Les boucles d'eau purifiée et la qualification. Focus sur la QP
- La mesure en continu dans l'eau à usage pharmaceutique (EUP)
- Candida auris, une espèce pathogène émergente "tueuse"
- Cleaning and disinfection program part of the lifecycle approach: a risk based rather arbitrarily imposed approach
- Eaux pharmaceutiques : les dessous de la maintenance des installations
- Pharma & the New Healthcare Economy. Ready or not ?
l’ASTM E2500 est une norme décrivant une approche de spécification, de conception et de vérification des équipements et systèmes de production du domaine Pharmaceutique / Biotechnologie. Elle s’applique aux équipements ; systèmes/processus ; utilités (Industrielle, propres) ; systèmes de laboratoire ; systèmes informatisés et automatisés pouvant affecter la qualité du produit et la sécurité du patient.
“L’ASTM E2500 est avant tout un état d’esprit, un changement de culture !”
Consensus approuvé en mai 2007, publié en juin 2007, puis ré-approuvé en 2012, ce guide est en ligne avec les attentes réglementaires internationales et notamment les ICH Q8, Q9, Q10 (Développement pharmaceutique/ “Quality by Design”, Quality Risk Management, Pharmaceutical Quality System). Soutenue par la FDA, cette approche répandue aux USA commence à être déployée en Europe, notamment auprès des industriels désireux de rationnaliser les phases de tests de leurs systèmes avant passage en exploitation et ainsi réduire leur Time to Market.
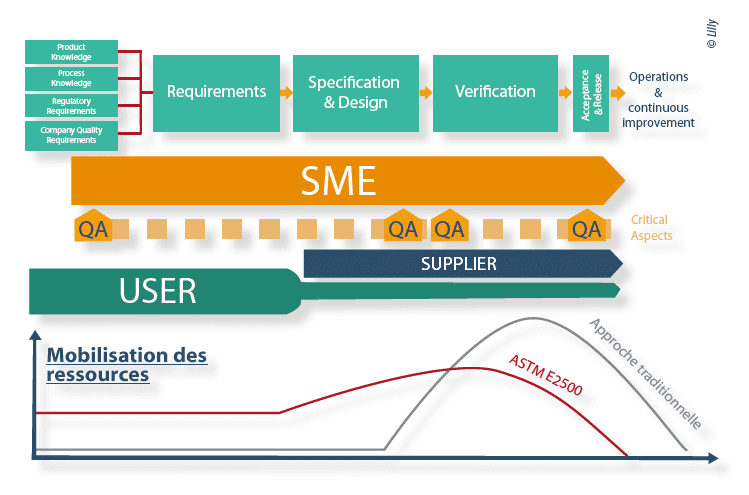
L’ASTM E2500(1) présente de nombreuses similarités avec le processus classique du cycle en “V” allant de la définition des besoins jusqu’au maintien de l’état validé. La grande nouveauté de ce texte ASTM E2500 réside dans le fait que l’ensemble des tests à réaliser ne suit plus une séquence rigide FAT/SAT/IQ/OQ/ PQ tel que décrit dans l’Annexe 15 des EU GMP. L’ensemble de ces tests, rassemblé sous le terme unique de “Vérification” peut désormais être organisé de façon plus libre et plus rationnelle afin de gagner en efficacité et de s’adapter à chaque contexte.
Le modèle ASTM
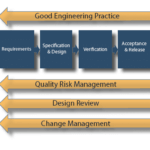
Le modèle ASTM E2500(1) s’articule autour de 4 étapes et de 4 processus transverses :
- 4 étapes : Requirements ; Specification & Design ; Verification ; Acceptance & Release.
- 4 processus transverses : Good Enginneering Practices ; Quality Risk Management, Design Review, Change Management.
Le modèle ASTM E2500 met en lumière de nouveaux acteurs : les Subject Matter Experts et les fournisseurs.
Le principe
La méthode ASTM E2500 permet de maîtriser l’implémentation d’un système en production et de sécuriser les projets en se focalisant sur les aspects critiques d’un point de vue GMP, à chaque étape du procédé.
L’approche par management du risque focalisée sur la qualité du produit et la sécurité du patient permet d’adapter les efforts de spécification des besoins et de rationnaliser les vérifications.
Les étapes
Etape 1 : Requirements
Les “requirements” sont la base de la Vérification, l’ensemble de la pyramide documentaire relative aux vérifications se construit sur ces fondations. Il est important qu’ils soient clairement définis. Les données d’entrée sont la connaissance du produit, la connaissance du procédé de fabrication, les requis réglementaires ainsi que les requis internes à la société. L’implication des utilisateurs et SME dans cette étape est alors primordiale, ils identifieront les différents besoins utilisateurs et faciliteront l’identification des aspects critiques.
Etape 2 : Specification & Design
Cette étape permet de vérifier que les besoins et exigences des différents utilisateurs ont bien été pris en compte par la cellule projet et le fournisseur. C’est une étape itérative, les réunions régulières permettent l’ajustement et la bonne compréhension des solutions proposées par les fournisseurs. Il est bien évident que pour un prototype le design ne pourra être défini que partiellement, parfois même la phase de vérification est nécessaire pour le finaliser.
Etape 3 : Vérification
La phase de vérification s’appuie sur deux principes majeurs : “le bon test” exécuté au “bon moment” = “right first”.
L’application de ces deux principes permet l’exécution d’un test “right first”. Exécuté trop tôt la validité de ses résultats risque d’être remise en cause par des modifications, démontages ou transport ; exécuté trop tard il pénalise le planning du projet.
En outre la démarche Vérification consiste à limiter les redondances de tests, les répétitions ne sont effectuées que s’il y a nécessité ou changement. Dans cette logique certains tests pourront être effectués chez le fournisseur, totalement ou partiellement. De même, certains tests pourront être délegués au fournisseur qui est expert sur son système.
Etape 4 : Acceptance & Release
L’Acceptance & Release autorise la libération du système pour sa mise en exploitation. Lors de cette étape il convient d’établir un document synthétique listant l’ensemble des tests effectués, les dates d’exécution ainsi que leur statut. Le système concerné peut alors être transféré à l’étape suivante.
Si toutefois des réserves subsistent lors de ce transfert, elles ne concernent que les aspects non critiques et leurs dates de résolution doivent être définies.
Les processus transverses
Processus 1 : Good Engineering Practices
Les Good Engineerng Practices relèvent du bon sens, une bonne organisation définie et partagée dès le début du projet facilite son implémentation. Les problèmes organisationels mal ou pas définis en début de projet viendront inévitablement polluer les problèmes techniques qui apparaitront de façon certaine.
Processus 2 : Quality Risk Management
Une analyse de risque centrée sur le produit permet d’identifier au plus tôt les paramètres critiques d’un point de vue qualité / sécurité patient (CQA, CPP). L’approche par management du risque qualité permet en outre de se focaliser sur la vérification des éléments critiques du système / de l’installation présentant un intérêt GMP.
Processus 3 : Design Review
La revue du design est un processus itératif, il faut donc l’aborder par étape au fur et à mesure de l’édition des documents de conception fournisseurs. Cette phase est critique pour s’assurer que la conception du système répond aux besoins. Elle permet de limiter les éventuelles modifications lors de la prise en main du système par les utilisateurs finaux, ainsi que les reprises de tests suite à modification qui impactent lourdement le démarrage en production. Comme précédement, il est évident que ce processus suit de près l’étape de Specificaton & Design et que par conséquent cette activité est à répéter à chaque changement de design.
Processus 4 : Change management
Il est évident que dans la démarche ASTM E2500, le processus de gestion de changement débutera plus tôt. La redondance des tests sera évitée au prix d’une maîtrise des changements, tests qui pourront être effectués chez le fournisseur même s’ils ne sont exécutés que partiellement.
En revanche, les modifications étant identifiées en amont à travers un design bien préparé, leur résolution devrait en être facilitée.
Les acteurs
Le processus décrit dans l’ASTM E2500 s’appuie sur une organisation dans laquelle les R&R sont clairement définis et dans laquelle on fait une meilleure exploitation de l’expertise des différents acteurs Projet :
- Les SME occupent des rôles centraux dans la démarche ASTM E2500(1). Indispensable dès le début du projet, ils participent à la définition des besoins, à l’identification des aspects critiques, à la revue de conception des systèmes, à l’élaboration de la stratégie de vérification ainsi qu’au choix des critères d’acceptabilité. Ils sont également porteur de l’approche par l’Analyse de Risque Qualité.
- Les fournisseurs, véritables SME des systèmes, peuvent se voir confier, selon leur niveau de maturité, certains tests de vérification ; ceci permettant d’atteindre plus facilement “le bon test” exécuté au “bon moment” = “right first”. Dans les projets conduits sous démarche ASTM E2500, les fournisseurs occupent un rôle primordial. Ils doivent connaitre les principes de l’ASTM E2500 et être formés aux exigences réglementaires, en particulier aux bonnes pratiques documentaires.
- Le QA focalise son contrôle et ses efforts sur les aspects critiques des procédés et systèmes pouvant impacter la qualité du Il valide notamment l’ensemble des critères d’acceptation des vérifications liées aux aspects critiques.
Cette organisation se traduit par une mobilisation différente des ressources tout au long du projet. Elle permet de profiter pleinement de l’expertise de chacun des acteurs, et ainsi d’obtenir une meilleure sécurisation des projets.
En synthèse
L’ASTM E2500 est une démarche qui dépasse les activités de vérification, elle couvre la totalité du projet et implique tous les acteurs dès le début du projet, dès la phase de définition des besoins. Par une forte anticipation de la phase de design et un savant dosage, elle permet une vérification efficiente en exécutant les bons tests au bon moment.
“Ceux qui ne marchent que fort lentement peuvent avancer bien davantage, s’ils suivent toujours le droit chemin, que ne font ceux qui courent et qui s’en éloignent” René Descartes

Gérôme AVENOSO – LILLY France
Gérôme Avenoso démarre sa carrière dans le nucléaire avant d’arriver chez Lilly en 1993 lorsqu’il met en place la structure C&Q. Après son intervention sur plusieurs projets locaux, il couvre les activités CQV sur l’ensemble des projets corporates réalisés en Europe. Il participe ensuite à un programme global composé de 4 projets similaires implantés en Italie, aux Etats- Unis, en France et en Chine, l’objet étant de répliquer pour être plus efficace. Il intégre enfin un groupe de réflexion sur la méthode C&Q visant à rendre la méthode plus simple et plus rapide en lien avec l’ASTM E2500 ainsi que favoriser l’ harmonisation des approches sur l’ensemble des sites Lilly.
avenoso_gerome@lilly.com

Jacqueline BESSET – ASSYSTEM
jbesset@assystem.com

Maëlle DESREUMAUX – ASSYSTEM
mdesreumaux@assystem.com

Stephane BERTRAND – LILLY France
bertrand_stephane@lilly.com
Partager l’article
Glossaire
ASTM : American Society forTesting Material
C&Q : Commissioning & Qualification
CPP : Critical Process Parameter
CQA : Critical Quality Attribute
CQV : Commissioning Qualification Validation
FAT : Factory Acceptance Tests
GEP : Good Engineering Practices
GMP : Good Manufacturing Practices
IQ : Installation Qualification
OQ : Operational Qualification
PQ : Performance Qualification
QA : Quality Assurance
R&R : Rôle & Responsabilité
SAT : Site Acceptance Tests
SME : Subject Matter Expert
Time to Market : Délai de commercialisation
Références
[1] ASTM E2500 : Standard Guide for Specification and Verification of Pharmaceutical and Biopharmaceutical Manufacturing Systems and Equipment
– ISPE Guide : Science and Risk-Based Approach for Delivery of Facilities, Systems, and Equipment
– ICH Guides ( International Conference on Harmonization) Annex 15 EU GMP