Sommaire
- Point de vue de la direction de l’inspection (DI) de l’ANSM sur le document ICH Q12
- ICH Q12 : les fondamentaux. Retours des travaux du GIC A3P ICH Q12
- First steps towards ICH Q12: Leveraging process understanding & development data to define process Established Conditions
- ICHQ12 Implementation from an Industry Perspective with a Focus on Established Conditions
- ICH Q12 compliance and Unified Quality and Regulatory Information Management
- Burkholderia cepacia a encore frappé
- Nouveau guideline Stérilisation de l’EMA
- How to store highly sensitive drugs? The benefit of functional coatings
Burkholderia cepacia a encore frappé
La qualité microbiologique des médicaments, et des dispositifs médicaux, est de la responsabilité des fabricants. De manière évidente, aucune contamination n’est tolérée dans les produits obligatoirement stériles et une maîtrise drastique (quantitative et qualitative) des micro-organismes présents dans les produits non-stériles est requise (absence des microorganismes spécifiés et des micro-organismes “objectionable”).
Dans le cas de produits à usage multiple, la présence de conservateurs doit les préserver de la contamination microbiologique lors de leurs utilisations successives. Le rôle des conservateurs n’est pas de décontaminer un produit initialement non conforme, mais de maintenir son état microbiologique stable.
Cette qualité microbiologique est assurée par la mise en œuvre de systèmes d’assurance de la qualité pharmaceutique, aux rangs desquels nous avons la stratégie de maîtrise de la contamination (Contamination Control Strategy, Annexe 1 BPF), la qualité par la conception (Quality by Design), la formation du personnel et sa qualification, la conception et la qualification des locaux, la conception et la qualification des équipements, les requis concernant les utilités (eau, air, gaz, vide), le suivi environnemental, la mise en œuvre de principes actifs et de matières premières, y compris les articles de conditionnement, à la bio-contamination contrôlée, le nettoyage et la désinfection des zones et matériels de production, l’utilisation de la stérilisation terminale, etc..
Tous ces systèmes visent à abaisser au plus bas le risque de contamination des produits pharmaceutiques et donc à assurer la sécurité des patients. Dans le cadre de la maîtrise des environnements, la désinfection des surfaces, avec la rotation de classes de désinfectants, participe à cet objectif dans différents domaines : production, contrôle qualité et secteur hospitalier. In fine, le contrôle qualité, avec toutes ses imperfections concourt à établir la conformité des produits pour leur libération.
Dans un communiqué du 7 novembre 2019, l’Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM), a indiqué que “… les produits désinfectants Surfa’safe premium et ses déclinaisons, ainsi qu’Opaster Anios, ne doivent plus être utilisés et sont rappelés par le fabricant“. Ce rappel volontaire du fabricant, a été motivé par la découverte de la présence de bactéries identifiées à Burkholderia cepacia dans plusieurs lots de Spray Surfa’safe premium (désinfection des surfaces et des dispositifs médicaux non invasifs) et de Pseudomonas oryzihabitans dans les lots d’Opaster Anios (désinfection des endoscopes). Le système de production d’eau utilisée pour ces fabrications serait la source de ces contaminations. Il y a donc un risque potentiel d’infection humaine car la plupart des bactéries du complexe Burkholderia cepacia (BCC) sont responsables d’infections graves chez l’homme, en particulier en cas d’immunodépression, notamment chez les patients atteints de mucoviscidose, mais parfois aussi chez des personnes non-immunodéprimées. Ces bactéries ont un génome de grande taille, qui leur confère de larges capacités métaboliques, différents facteurs de virulence et des résistances intrinsèques multiples aux antibiotiques, aux désinfectants et aux conservateurs. Les désinfectants en cause dans ce rappel sont largement utilisés dans le secteur médical hospitalier, dans les secteurs pharmaceutiques (zones de production, SAS, laveries…) et des dispositifs médicaux (désinfection des dispositifs à usage multiple), mais également dans les laboratoires de contrôle microbiologique !
Ce rappel signifie l’arrêt immédiat de l’utilisation de ces produits, la récupération de tous les lots en cours d’utilisation, ou non utilisés, et leur mise en quarantaine en attendant de suivre la procédure de renvoi au fabricant. La recherche de ces éventuels contaminants dans les lots utilisés pour la désinfection des zones de production, des laboratoires de contrôle, en vue de l’évaluation de l’impact potentiel sur les productions et les analyses, devrait aussi être envisagée. Ceci concerne également l’historique de mise en œuvre de ces produits. Enfin, cette situation permet d’anticiper une rupture plus ou moins longue des approvisionnements de ces produits et donc la nécessité de trouver des formulations alternatives, qu’il conviendra de valider. La validation de tous les produits de désinfection à réception est aussi une question, même pour ceux qui n’utilisent pas les produits incriminés. Plus généralement, la dissémination dans les environnements (air, surfaces) et les utilités (eau, boucle, circuits de gaz, etc…) devraient également être considérée sérieusement, car les impacts pourraient être dévastateurs.
Il s’agit d’un nouvel épisode de la longue saga des contaminations de produits de santé par des membres du complexe Burkholderia cepacia (BCC), dont certaines ont pu provoquer des épidémies, avec des cas mortels, un peu partout dans le monde (Garrity et al., 2005 ; Jimenez et al., 2007, Torbeck et al., 2011). Afin de mieux appréhender les risques liés à ces bactéries du complexe Burkholderia cepacia, nous allons commencer par rappeler leurs caractéristiques majeures puis nous aborderons les moyens de les détecter, de les identifier et de les tracer.
1. Caractéristiques majeures
1.1 Taxonomie
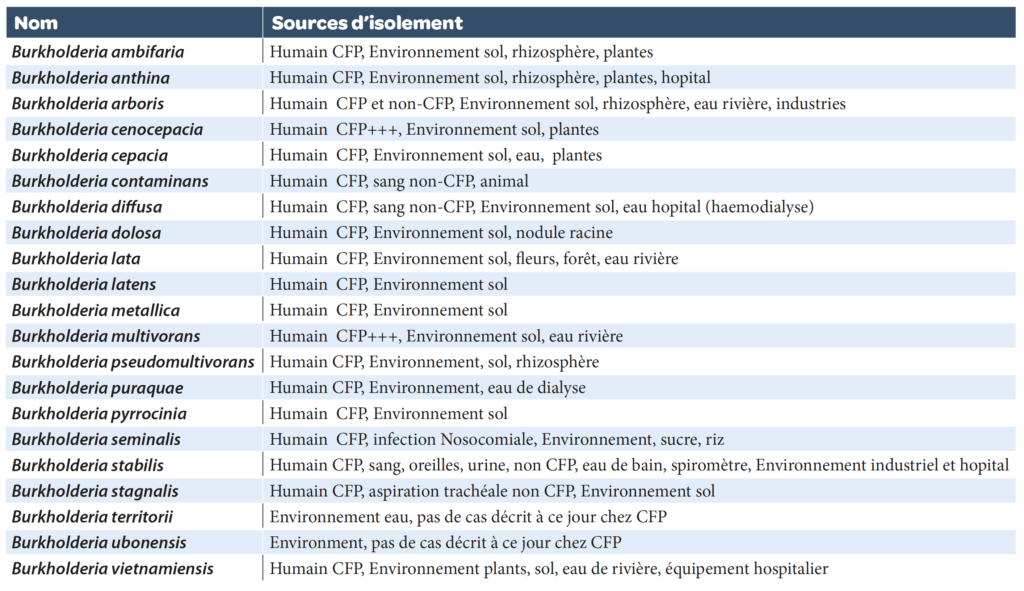
Burkholderia cepacia complexe (BCC): Le genre appartient à la famille des Burkholderiaceae (Burkholderia, Ralstonia, Cupriavidus, Pandoraea, etc..) (nom du genre donné en hommage au bactériologiste Burkholder qui découvrit l’agent de la pourriture de l’ognon, qui deviendra B. cepacia). Il sagit de ß-Proteéobactéries (bactéries à coloration de Gram négative), en forme de bâtonnets droits ou incurvés (0,5-1 x 1,5-4 µm), mobiles (flagelles polaires), aérobies, non-fermentaires, et non sporulées. L’espèce type est Burkholderia cepacia sensu stricto. Le complexe Burkholderia cepacia est constitué, à ce jour, de 21 espèces valides très difficiles à différencier entre elles selon les critères phénotypiques et moléculaires usuels (Tableau 1).
1.2 Habitats
Ces bactéries sont parmi les plus versatiles des bactéries Gram négatif. Elles sont ubiquitaires. Elles sont retrouvées fréquemment dans les environnements naturels (eaux, sols, végétaux [commensales ou pathogènes], aliments), dans les environnements industriels, y compris pharmaceutiques, (systèmes d’eau, air, sol, matières premières, produits finis avec ou sans conservateurs, solutions salines, solutions désinfectantes, etc…) ou dans les environnements hospitaliers (eau de dialyse, systèmes d’eau). Les animaux et les êtres humains ne sont pas considérés comme un habitat naturel pour BCC, dans l’état actuel de nos connaissances.
1.3 Aptitudes métaboliques et caractéristiques de dissémination
Leurs capacités métaboliques étendues, liées à leurs grands génomes (6-9 Mb), leurs permettent d’utiliser de nombreux substrats très efficacement, même en faibles quantités (oligotrophe) et de coloniser des environnements aussi différents que l’eau d’une mare ou d’un système d’eau purifiée, un sol, ou une plante et ses racines, et d’être pathogène opportuniste pour l’animal ou l’être humain. En effet elles possèdent aussi de nombreux gènes impliqués dans les phénomènes de résistances multiples aux antibiotiques, aux conservateurs et aux désinfectants. Elles peuvent former des biofilms et possèdent plusieurs facteurs de virulence. Elles ont des capacités de disséminations particulières par l’eau et les aérosols, mais aussi à partir des surfaces où certaines souches peuvent résister à des conditions de dessiccation pendant quelques jours, en plus de résister aux désinfectants. Elles ont également une propension à se transmettre de patient à patient (contact, aérosols). Elles peuvent rester viables dans l’eau pendant des mois. Elles sont donc très souvent associées à l’eau et les produits à risques sont principalement aqueux mais pas uniquement, surtout s’ils peuvent atteindre les voies respiratoires.
1.4 Pathogénicité
Les espèces de BCC sont considérées comme des pathogènes opportunistes. Les personnes les plus à risque sont les patients immunodéprimés (y compris très jeunes enfants, personnes agées, les patients atteint de cancer, etc..) et surtout les patients atteint de mucoviscidose (Lipuma et al. 2005, Gautam et al., 2016). Il est maintenant reconnu que les souches pathogènes chez l’homme peuvent provenir de l’environnement naturel. Les études épidémiologiques ont montré que les espèces les plus souvent rencontrées dans les cas cliniques chez les patients atteint de mucoviscidose sont par ordre décroissant B. cenocepacia, B. multivorans et B. cepacia. Elles présentent un tropisme particulier pour le système respiratoire chez les patients atteint de mucoviscidose. Les contaminations peuvent se faire à partir d’aérosols contaminés, de solutions désinfectantes contaminées, de solutions de bain de bouche contaminées, de nébuliseurs, de gants de soins imprégnés, de crèmes, de solutions de rinçage des yeux, etc…
Des épidémies, dont certaines dues à des produits pharmaceutiques contaminés par ces espèces, ont été observées dans différents services hospitaliers dans le monde (Australie, Angleterre, Autriche, Inde, Suisse, USA, etc…) (Marquez et al., 2017). Des clones hyper virulents de ces espèces (ST-28 et ST-32 pour B. cenocepacia ou ST-16 pour B. multivorans) ont était caractérisés à partir de plusieurs épidémies (Baldwin et al., 2008 ; Drevinek et Mahenthiranlingam, 2010). Des cas mortels ont été rapportés et une réduction significative de l’espérance de vie de ces patients liée à la contamination par BCC est prouvée. Les autres espèces du complexe BCC, ne représentent qu’environ 10% des cas cliniques répertoriés chez l’homme, mais elles ont toutes été retrouvées à l’exception de B. ubonensis et B. territori. Les descriptions récentes de ces espèces et les difficultés d’identification précises pourraient expliquer l’absence de cas documenté à ce jour. Un cas récent d’épidémie à B. stabilis dans un service hospitalier en Suisse a été décrit et documenté par séquençage génomique total es isolats (Seth-Smith et al., 2019). La contamination avait pour source des gants pré-humidifiés pour le lavage des personnes alitées.
Quelques cas de contamination par BCC chez des personnes non-immunodéprimées ont été rapportés dans la littérature. Une attention particulière est portée sur les très jeunes enfants et sur les personnes âgées, qui sont considérées comme des personnes à risque. La plupart des espèces du complexe sont rencontrées dans nos environnements pharmaceutiques (A. Carlotti, 2018).
2. BCC et industries pharmaceutiques
Burkholderia cepacia complexe est l’un des contaminants les plus fréquemment rencontré dans les produits pharmaceutiques stériles ou non-stériles. Ils sont l’une des principales causes de rappel de lots de produits pharmaceutiques pour des raisons microbiologiques.
Les bactéries du complexe BCC sont considérées comme des micro-organismes ” objectionable ” (opposable, indésirable) pour les produits pharmaceutiques non-stériles aqueux, destinés à certains des patients à risque vis-à-vis de BCC. Les sources et causes de contamination à BCC des produits pharmaceutiques ont été déduites de l’expérience des nombreux rappels. Il s’agit principalement : de procédures inadéquates de nettoyage, de l’utilisation d’eau du robinet pour rincer des équipements, de la maîtrise insuffisante des systèmes de production d’eau (désinfection insuffisante, absence de validation, absence de maintenance, présence de biofilms), de design inapproprié des systèmes d’eau (formation de biofilms), d’analyses microbiologiques inadéquates, de matières premières contaminées (eau ou autres), d’absence de recherche systématique de BCC, de l’utilisation de systèmes conservateurs non éprouvés vis-à-vis de BCC, de procédures inadéquates de séchages des équipements, de stockage inapproprié, de stérilisation terminale inadéquate, de validation inadéquate du suivi environnemental, etc… Ces bactéries peuvent se développer dans les solutions avec conservateurs, le produit est estimé conforme lors de la libération, puis la contamination pauci microbienne initiale se développe en quelques semaines et le produit est alors totalement contaminé et non conforme. Ces sources et causes de contamination devraient être mieux maîtrisées.
3. BCC détection, identification et typage
Jusqu’à récemment, il n’y avait pas de texte officiel consacré à la recherche spécifique des bactéries du complexe BCC, dans les produits non-stériles que ce soit pour les USA ou l’Europe. Cependant en raison de la recrudescence, depuis les années 2000, des cas de contaminations de produits pharmaceutiques ou de dispositifs médicaux, souvent impliqués dans des infections iatrogènes ou nosocomiales chez l’homme, et des rappels de lots inhérents, la FDA a émis de nombreuses alertes sur ce problème de santé publique et sur le besoin de contrôles systématiques. La pharmacopée US a donc enfin publié en 2018, en urgence (!), la préversion du chapitre USP <60> “Microbiogical examination of non-sterile products-Tests for Burkholderia cepacia complex“, pour avis. Ce texte n’est pas harmonisé (<1000) avec la pharmacopée européenne, il est applicable à partir de décembre 2019.
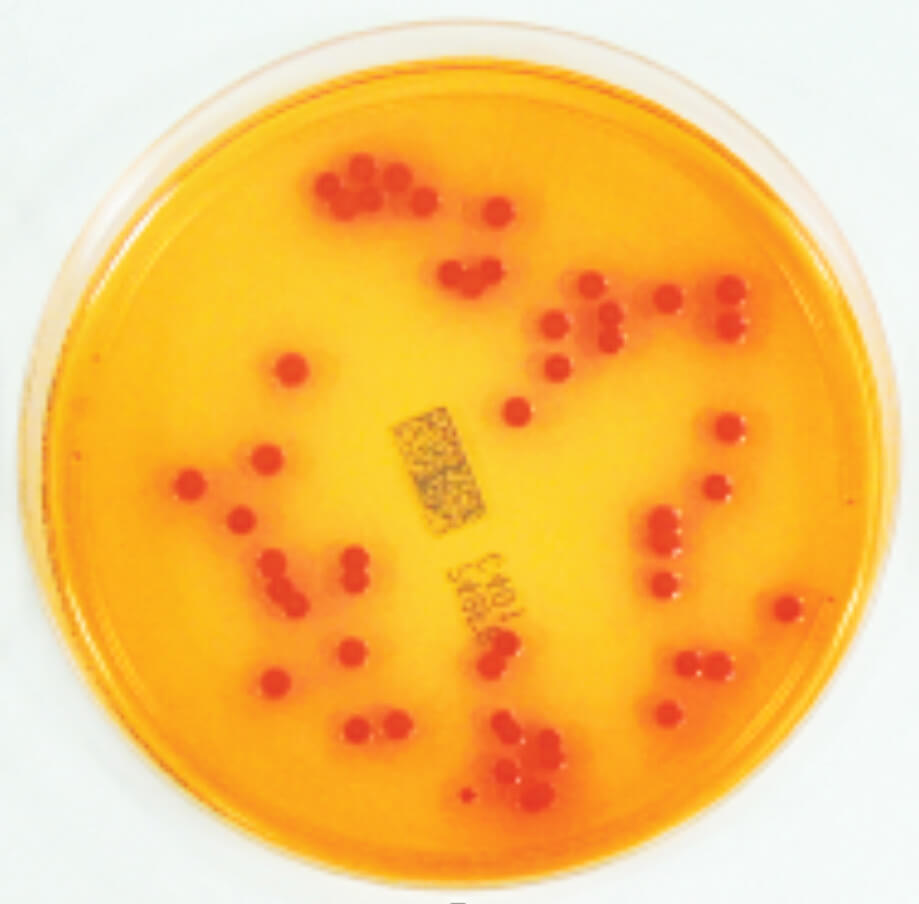
Ce texte recommande d’utiliser un milieu sélectif pour BCC, le milieu BCSA (Burkholderia cepacia selective agar) dans un protocole standardisé afin de déterminer l’absence de BCC dans les produits à risque tels que produits à inhaler, préparations aqueuses pour administration orale, oro-mucosale, cutanée ou nasale. Toutes les bactéries du complexe BCC décrites à ce jour sont aptes à croître sur ce milieu, au contraire d’un grand nombre d’autres bactéries (e.g. Pseudomonas aeruginosa) qui sont inhibées par le cristal violet et les antibiotiques présents dans le milieu. Certaines bactéries non-BCC peuvent néanmoins se développer sur ce milieu. Les colonies suspectes sur milieu BCSA apparaissent généralement verdâtre-brun avec un halo jaunâtre ou blanc avec un halo rose-jaunâtre (indicateur coloré rouge de phénol). Cette méthode est présomptive et nécessite une confirmation de l’identification des colonies suspectes.
Nous avons transposé cette approche au contrôle des systèmes d’eau, où l’emploi de milieu sélectif-chromogène (e.g. Milieu Chrom ID Burkholderia cepacia [CIBC]) (Figure 1) ou sélectif (e.g. milieu BCSA), permet de détecter spécifiquement les membres du complexe Burkholderia cepacia, en mélange avec les microorganismes classiques de l’eau, de manière plus efficace que sur les milieux usuels non adaptés pour BCC (A. Carlotti, 2018). La recherche de BCC est parfois difficile car ces bactéries, comme souvent pour les bactéries de l’eau, ne supportent pas le passage d’un milieu pauvre à un milieu riche. Ces méthodes sont présomptives et nécessitent toutes une confirmation de l’identification des colonies suspectes.
La recherche des bactéries BCC dans les solutions désinfectantes et l’évaluation de l’efficacité des conservateurs (” challenges tests “) sur les produits sont également réalisées dans nos laboratoires.
Enfin, un test qPCR a été publié récemment pour la recherche spécifique de Burkholderia cepacia dans les produits pharmaceutiques contaminés, même faiblement, avec ces bactéries (Jimenez et al., 2018).
Le besoin de méthodes rapides spécifiques pour la détection de l’ensemble des membres de BCC, par exemple pour un suivi in-line/on-line, pour une détection systématique, est notable.
L’identification des bactéries au complexe BCC est suffisante dans un premier temps pour établir la présence ou l’absence, dans les conditions de l’essai, de ces microorganismes indésirables.
L’identification précise des espèces au sein du complexe est essentielle pour évaluer l’ampleur de la menace (B. cenocepacia, B. multivorans et B. cepacia sont bien plus à risque que B. territori) et pour tracer la route de la contamination, voire identifier la présence de biofilms. Dans ces cas d’investigations, il peut même être nécessaire de caractériser les isolats (typage) au sein de la même espèce, pour déterminer si l’hypothèse de l’implication d’une seule et même souche dans la contamination étudiée peut être retenue ou non (source commune).
L’identification phénotypique (biochimique, protéomique) avec les solutions commerciales est difficile pour BCC en raison des fortes similitudes phénotypiques entre les espèces, de l’expression variable des caractères selon l’état physiologique des cultures et en raison des limitations des solutions disponibles. La spectrométrie de masse (MALDI-TOF) donne de bons résultats pour les membres du complexe Burkholderia cepacia lorsque les espèces sont revendiquées, quel que soit le système. Par exemple, Fehlberg et al., (2013) ont rapporté que 100% des isolats de BCC testés étaient correctement identifiés au genre, mais que 23 % n’étaient pas identifiés correctement à l’espèce.
Nous avons observé de bons résultats d’identification à l’espèce avec le système Vitek MS (A. Carlotti, 2018), avec moins de 5 % d’erreur pour les espèces revendiquées dans la base de données pour plus de 50 isolats environnementaux pharmaceutiques assignés à BCC par séquençage multilocus.
L’identification génotypique avec le séquençage comparatif des gènes codant l’ARNr 16S (partiel [court] ou quasi-total [long]) permet une identification fiable au complexe BCC, mais pas une identification correcte des espèces au sein du complexe car elles ne sont pas différenciées significativement avec ce marqueur. Nous avons noté néanmoins, de meilleures performances avec le séquençage quasi-total, par rapport au séquençage partiel, pour les espèces B. vietnamensis et B. multivorans (A. Carlotti 2018).
L’utilisation du séquençage unilocus partiel des gènes recA et /ou hisA, permet généralement une bonne identification à l’espèce (Martina et al., 2017), nous l’employons régulièrement pour les analyses de routine.
La méthode de choix actuelle pour une identification précise à l’espèce est la méthode de séquençage multilocus (MLSA) (Baldwin et al., 2005, Spiker et al., 2009, Martina et al., 2017, A. Carlotti, 2018) de 7 gènes (atpD, gltB, gyrB, lepA, phaC et trpB), qui permet d’identifier exactement l’espèce au sein de BCC, mais également de déterminer le type moléculaire de chaque souche dans la même analyse (typage), nous l’employons pour les analyses d’investigation.
Enfin, dans notre laboratoire nous utilisons avec succès le séquençage génomique total (WGS) qui est l’approche ultime pour identifier, typer et caractériser les facteurs de virulence, les multiples résistances aux antibiotiques, aux désinfectants et aux conservateurs des souches considérées. Nous avons obtenu de très bons résultats pour des isolats de B. lata et B. contaminans, en particulier, provenant d’environnements pharmaceutiques, pour lesquels nous avons obtenu une identification exacte, un typage des souches et identifié plus de 160 gènes impliqués dans la virulence, la résistance aux antibiotiques, désinfectants et conservateurs (A. Carlotti, 2018 ; A. Carlotti, 2019).
Conclusion
Burkholderia cepacia complex regroupe 21 espèces de bactéries aux capacités métaboliques étendues leur permettant de coloniser de nombreux environnements, en particulier les eaux. Certaines de ces espèces sont des pathogènes opportunistes redoutables pour des patients immunodéprimés (e.g. patient souffrant de mucoviscidose) et parfois pour la population non-immunodéprimée, en raison de leurs résistances multiples aux antibiotiques, aux désinfectants, aux conservateurs, aux conditions environnementales très défavorables, de leurs facteurs de virulence et de leurs capacités de dissémination. Elles sont parmi les plus fréquents contaminants des produits pharmaceutiques (aqueux) et des dispositifs médicaux. Des produits pharmaceutiques contaminés ont été la source de contaminations de patients, parfois mortelles, voire d’épidémie dans des services hospitaliers, à plusieurs reprises ces 20 dernières années.
L’actualité illustre particulièrement l’importance de ce groupe et les instances réglementaires, à travers les inspections, les rappels de lots ont incité la pharmacopée US, à enfin donner des directives claires pour la recherche systématique de ces micro-organismes indésirables dans les produits pharmaceutiques. Nous déplorons l’absence d’un tel texte dans la pharmacopée Européenne, le danger n’est pas moindre en Europe qu’aux USA. Il revient au fabricant la responsabilité d’évaluer les risques et de prendre les mesures nécessaires pour assurer la qualité microbiologique de leurs produits. Nous avons un besoin prégnant de méthodes microbiologiques rapides spécifiques pour ces micro-organismes pour un suivi in-line/on-line. Nous avons cependant à notre disposition tous les moyens de détection (microbiologie classique et moléculaire), d’identification (séquençage comparatif unilocus, multilocus et génomique) et de typage des souches pour des investigations efficaces. Ceci permet également une surveillance pertinente des systèmes de production d’eau pharmaceutique, une validation des désinfectants lot par lot à réception, et une évaluation de l’efficacité des conservateurs ciblée sur BCC. Nous travaillons activement sur les moyens de lutte et de prévention de ces contaminations.
Il est intéressant de noter que les 18 et 19 mars 2020, se tiendra à Tours, le congrès biennal de Microbiologie de l’Association A3P dont le programme comporte quatre thématiques : Méthodes alternatives en microbiologie, Contrôles microbiologiques des produits biologiques, Contrôles microbiologiques “In-line /on-line” et une partie sur les enseignements à tirer des ” warning letters ” et injonctions, pour cause microbiologique.
Nous pourrons donc aborder ces problématiques concrètes et d’actualité de manière approfondie au sein de notre réseau professionnel.
Partager l’article

Arnaud Carlotti – EUROFINS
Depuis plus de 30 ans, Arnaud CARLOTTI est passionné par la microbiologie industrielle et les problématiques de production en condition stériles, investigations des non conformités, root cause analyses, proposition et mise en œuvre des CAPAs.
En tant qu’expert reconnu, il a publié à ce jour plus de 30 articles scientifiques et chapitres d’ouvrages (eg. 2018 PDA/DHI publishing «Contamination Control volume 5 chapter 14).
Bibliographie
Carlotti A. (2018) Burkholderia cepacia complex several absolutely-objectionable bacteria species. In Contamination control in healthcare product manufacturing, Volume 5, Chapter 14, Madsen R. E. and Moldenhauer J. editors, PDA Bethesda and DHI River Grove Publishing.
Carlotti A. (2019) Bactéries de l’espèce Burkholderia lata dans l’industrie pharmaceutique, apports de la génomique. Quinzième Congrés de la Société Française de Microbiologie, ” Microbes “, 30 septembre au 2 Octobre, 2019, Cité des Sciences et de l’Industrie, Paris.
Baldwin A., Mahenthiralingam K., Thickett D., Honeybourne M., Maiden et al. (2005) Multilocus sequence typing scheme that provides both species and strain differentiation for the Burkholderia cepacia complex. J Clin Microbiol 43, 4665–4673.
Baldwin A., Mahenthiralingam E., Drevinek P., Vandamme P., Govan J., et al. (2007)
Environmental Burkholderia cepacia complex isolates in human infections. Emerg Infect Dis, 13, 458–61.
Drevinek P. and Mahenthiralingam E. (2010) Burkholderia cenocepacia in cystic fibrosis: epidemiology and molecular mechanisms of virulence. Clin Microbiol and Infect Dis, 16, 7, 820–830.
Fehlberg L., Andrade L., Assis D. et al., (2013). Performance of MALTI-Tof Mass Spectometry for species identification of Burkholderia cepacia complex clinical isolates. Diag Microbiol and Infect. Disease 77, 2, 126-128.
Garrity G., Bell J. and Lilburn T. (2005) Burkholderiaceae in Bergey’ manual of systematic bacteriology, second edition, Vol. 2. The Proteobacteria part C. Garrity G. editor. New York, Springer.
Gautam V., Patil L., Kuma S., et al., (2016) Multilocus sequence analysis reveals high genetic diversity in clinical isolates of Burkholderia cepacia complex from India. Sci Rep, 6, 1-9.
Jimenez L. et al. (2007) Microbial diversity in pharmaceutical product recalls and environments. PDA J. Pharm Sci Tech, 61, 5, 383–399.
Jimenez L. et al. (2018) Real-Time PCR Detection of Burkholderia cepacia in Pharmaceutical Products Contaminated with Low Levels of Bacterial Contamination. PDA J Pharm Sci and Technol, 72, 73–80
Lipuma J. (2005) Update on the Burkholderia cepacia complex. Curr Opin Pulm Med, 11, 6, 528–33.
Marquez L., Jones K., Whatley E., Koy T., Revell P. et al. (2017) An outbreak of Burkholderia cepacia complex infections associated with contaminated liquid docusate. Infect Control Hosp Epidemiol, 38, 5, 567–573.
Martina P., Leguizamon M., Prieto C., Sousa A., Montanaro et al. (2018). Burkholderia puraquae sp. nov., a novel species of the Burkholderia cepacia complex isolated from hospital settings and agricultural soils. Int J Syt Evol Microbiol, 68, 14–20.
Seth-Smith H., Casanova C., Sommerstein Rami, et al., (2019) Phenotypic and genomic analyses of Burkholderia stabilis clinical contamination in Switzerland. Emerg Infect Disease, 25, 6, 1084-1092.
Spilker T., Baldwin A., Bumford A., Dowson C., Mahenthiralingam E., and LiPuma, J. (2009). Expanded Multilocus Sequence Typing for Burkholderia Species. J Clin Microbiol, 47, 2607–2610
Torbeck L. Raccasi D., Guilfoyle D., Friedman R., Hussong D. (2011) Burkholderia cepacia : This Decision Is Overdue. PDA J Pharm Sci Technol, 65, 5, 535–543.


