Sommaire
- Le 6 Sigma et l'Excellence Opérationnelle. Juste du bon sens ?
- Combien de valeurs sont nécessaires pour avoir un échantillon représentatif ?
- Exploiter la donnée pour optimiser le pilotage d'un procédé
- Statistical modeling: The need for a reliable approach to improve process knowledge and understanding
- Bayesian approach in cosmetical research : Application to a meta-analysis on the anti-pigmenting effect of vitamin C
- Comparabilité, équivalence, similarité... Comment les statistiques peuvent nous aider à en faire la démonstration. Et bientôt la fin d'un "blind test" pour les autorités de santé et les industriels
- Le maintien du statut validé, une étape du cycle de validation
- Stratégie de validation des procédés et mise en application de l'Annexe 15 des BPF et des guidances FDA. Vérification continue des procédés (CPV)
La validation est découpée en cinq grandes phases qui sont :
– La planification et définition des besoins
– La définition des spécifications et de la configuration
– La vérification
– L’exploitation
– La mise hors service
Le processus de validation peut être schématisé selon le cycle de vie en boucle représenté ci-contre.
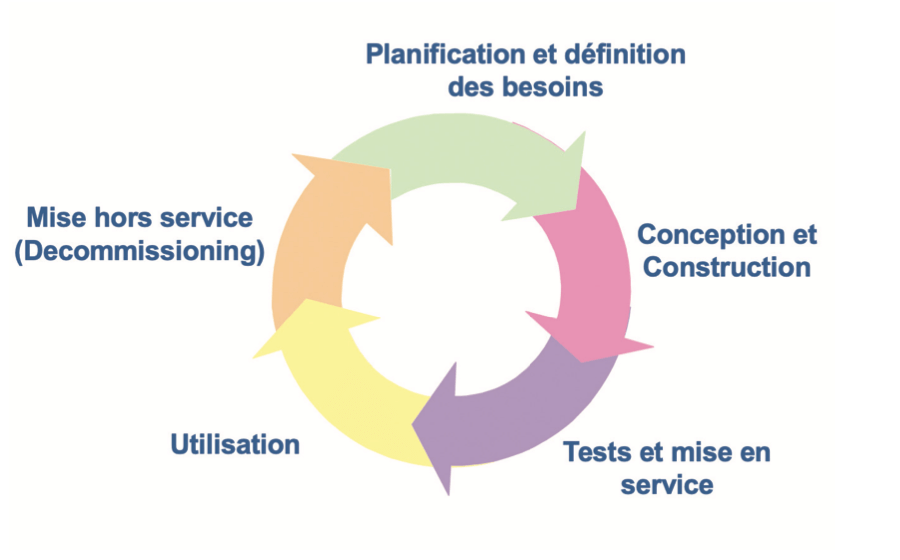
Après les phases de définition des besoins, de conception et de qualification (tests et mise en service), intervient la phase d’utilisation sur laquelle le maintien du statut validé doit être vérifié. Cette étape, généralement la plus étendue dans le temps, a pour objectif de prouver que l’élément considéré est maintenu dans un état validé permanent tout au long de son utilisation.
Ce que disent les textes réglementaires
- Eudralex(1), volume 4, Annexe 15, paragraph 4 (mars 2015) :
“Equipment, facilities, utilities and systems should be evaluated at an appropriate frequency to confirm that they remain in a state of control”. - BPF(2), Annexe 15, paragraphe 4 :
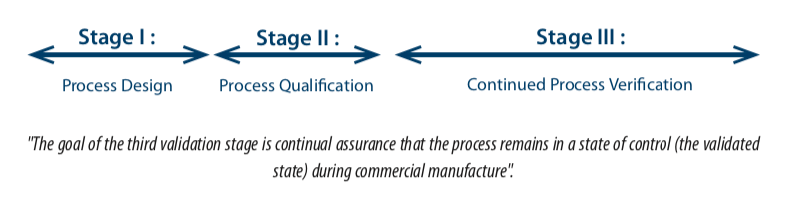
“Les équipements, les installations, les utilités et les systèmes doivent être évalués à une fréquence appropriée pour confirmer qu’ils demeurent bien sous contrôle”. - le guide FDA(3), Guidance validation : General principles and practices, paragraph 4– January 2011, défini le cycle de validation en 3 étapes :
En pratique
Afin de répondre aux différentes exigences réglementaires et garantir le maintien du statut validé, il est nécessaire de mettre en place différents processus de façon robuste.
• Les procédures d’utilisation doivent être claires et détaillées afin de faciliter la compréhension de celle-ci par toutes personnes pouvant les utiliser et ainsi permettre une reproductibilité lors de la réalisation des différentes tâches. Il est nécessaire que les paramètres critiques du procédé, définit lors de l’étape de qualification, soient décrits et identifiés dans les procédures.
• Chaque personne réalisant ou supervisant les opérations de fabrication de médicament doit être soumise au processus de formation du personnel mis en place dans l’entreprise. Ce processus doit être clair, détaillé et rigoureux. Dans le cas de certaines activités critiques, il est nécessaire de réaliser une habilitation comme par exemple les habilitations au mirage manuel pour les personnes réalisant des contrôles en cours de production, les habilitations par media fill (MFT) pour les opérations réalisées en milieu aseptique. Ces habitations doivent être réévaluées périodiquement afin de de s’assurer de l’absence de dérive.
• Le système de gestion des modifications en place doit permettre de maitriser l’impact des modifications apportées aux équipements, aux systèmes ou aux procédés validés. Le processus de gestion des changements doit décrire les mesures à mettre en œuvre en cas de modification d’une matière première, d’un composant d’un produit, d’un équipement de production, de tout ou partie d’un système informatisé, de l’environnement de fabrication, de la méthode de production ou d’essai, ou de tout autre changement susceptible d’influer sur la qualité du produit ou la reproductibilité du procédé. La maitrise des modifications peut-être assurée au moyen de la réalisation d’une évaluation d’impact pour chaque changement par une équipe pluridisciplinaire (par exemple secteur règlementaire, validation, maintenance, production…).
• Pour les systèmes les plus critiques, une qualification périodique est réglementairement exigée parallèlement à la maintenance préventive (procédé de nettoyage, remplissage, mirage, stérilisation, remplissage aseptique…). On entend par qualification périodique d’un système, l’ensemble des activités qui démontrent que les fonctionnalités critiques telles que définies lors de la phase de conception sont toujours sous contrôle. Dans certains cas, la qualification périodique peut se substituer à certains tests comme :
– les activités de maintenance préventive et de calibration qui incluent des tests de fonctionnalités critiques (alarmes, systèmes d’éjections …)
– les challenges tests principalement pour les opérations de conditionnement et les suitability test au laboratoire de contrôle, permettant d’assurer un bon fonctionnement d’un système avant le démarrage des opérations.
La fréquence des tests doit reposer sur une analyse de risque dans laquelle peuvent être intégrées les résultats des précédentes qualifications, la criticité de l’équipement ou du système.
• L’ensemble des installations, utilités, équipements et systèmes informatisés doivent être évalués à une fréquence appropriée pour confirmer qu’ils demeurent bien sous contrôle. Ceci peut être tracé au travers d’une revue périodique de validation. Cette revue doit permettre :
– de fournir une justification du maintien du statut validé des éléments ayant un impact direct sur la qualité du produit.
– d’identifier la nécessité de requalifier ou de revalider tout ou une partie de ces éléments.
• La maintenance préventive doit être gérée et mise en place dès l’utilisation d’un équipement. Pour ceci, lors de l’étape de qualification, une analyse des différents organes de cet équipement doit être réalisée. De cette analyse doivent être mise en place les plans de maintenance associés, catégorisés en fonction de la criticité. Ceci afin d’entretenir et contrôler les équipements et ainsi permettre de conserver l’état validé de celui-ci.
• Les revues qualité périodique produit doivent être réalisés à fréquence définie. Lors de cette revue, le suivi des attributs qualité critique et les paramètres critiques Qualité permettent de surveiller la qualité du produit et la performance du procédé et ainsi vérifier la répétabilité du procédé et confirmer le maintien du statut validé.
Pour conclure, la maitrise de la qualification initiale des équipements et le respect des processus cités auparavant durant la phase d’utilisation sont indispensables afin de pouvoir ensuite mettre en place un suivi en continu des procédés (CPV) de manière à détecter les dérives éventuelles; ceci permettant d’agir avant l’apparition d’une non-conformité.
Plusieurs questions se posent concernant la mise en place de CPV. Un groupe de travail (GIC) étudie ce sujet afin de créer un guide permettant l’aide à la mise en place dans les industries de remplissage aseptiques.
Partager l’article

Sabrina GALLAY – ASPEN
Expert validation depuis 12 ans (validation de procédés, validation de nettoyage, validation article). Je me suis spécialisée sur le maintien du statut validé depuis 4 ans. Aspen Notre dame de Bondeville
sgallay@fr.aspenpharma.com
Bibliographie
(1) Eudralex (1), volume 4, Annexe 15, paragraph 4 (mars 2015)
(2) BPF, Annexe 15, paragraphe 4.
(3) Guidance validation : General principles and practices, paragraph 4– January 2011