Sommaire
- La restriction des PFAS dans l’industrie : enjeux réglementaires et impacts sur l’industrie pharmaceutique
- La technologie Blow-Fill-Seal dans l’industrie pharmaceutique : performance, applications et durabilité
- Key Allies in Preventing Contaminants and Impurities in Bioproduction
- Choosing the right vial: packaging sterile drug products with foresight
- Combination Products in the United States and European Union: Differences and proposed strategy to prepare common CTD Quality Module 3
- Blood plasma processing. When every drop counts
- L’analyse de la normalité en Continued Process Verification
- Qualification of impurities
- Pharma 2052
La technologie Blow-Fill-Seal dans l’industrie pharmaceutique : performance, applications et durabilité
La technologie Blow-Fill-Seal (BFS) a été développée en 1963 pour le conditionnement non stérile de produits alimentaires, cosmétiques et de dispositifs médicaux. La première machine Blow-Fill-Seal, appelée BottelPack (BP), est commercialisée dès 1964. À partir des années 1970, le procédé est progressivement adopté par l’industrie pharmaceutique pour le remplissage aseptique de solutions à grande échelle.

La technologie Blow-Fill-Seal (BFS) a été développée en 1963 pour le conditionnement non stérile de produits alimentaires, cosmétiques et de dispositifs médicaux. La première machine Blow-Fill-Seal, appelée BottelPack (BP), est commercialisée dès 1964. À partir des années 1970, le procédé est progressivement adopté par l’industrie pharmaceutique pour le remplissage aseptique de solutions à grande échelle.
La technologie aseptique Blow-Fill-Seal
La technologie Blow-Fill-Seal (BFS) qui se traduit par : formation / remplissage / scellage, est un procédé qui se déroule de manière continue, automatisée, sans intervention humaine, Ce qui garantit un très haut niveau d’assurance de stérilité. Contrairement aux méthodes traditionnelles, il n’est pas nécessaire de transférer les contenants entre différentes machines ou d’effectuer des manipulations manuelles.
Le procédé BFS suit une séquence en cinq étapes principales, opérée en continu dans un système fermé :
– Préparation et extrusion : Des granulés de plastique pharmaceutique (le plus souvent, du polyéthylène basse densité ou du polypropylène) sont chauffés dans des vis d’extrusion à 220-230°C.
– Moulage par plaquage : Le plastique fondu est extrudé sous forme d’un tube, capturé dans un moule. Le tube encore chaud est pris entre les deux demi-moules, qui se referment instantanément. La partie inférieure de l’unidose est alors formée par plaquage du plastique contre les parois du moule, grâce à un système de vide et de refroidissement, sous une douche d’air stérile. Le mandrin est positionné au-dessus du moule pour assurer les étapes suivantes.
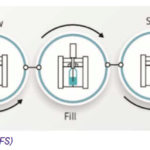
Remplissage : Le mandrin sert également à remplir le contenant de manière aseptique, sans ouvrir le moule. La solution pharmaceutique est injectée via des aiguilles stériles, après avoir été stérilisé soit par ultra-filtration , soit par la chaleur.
– Scellage et formation : Une fois le remplissage terminé, la partie supérieure du moule se referme pour pour former la partie haute du contenant (col et bouchon), qui est immédiatement scellée hermétiquement par thermoformage. Conformément au GMP, l’étanchéité des doses est contrôlée à 100%.
– Démoulage et séparation : Le moule s’ouvre et libère les contenants formés, encore attachés entre eux : c’est ce qu’on appelle une paraison d’unidoses. Cette paraison est ensuite séparée en unidoses individuelles, ou barrettes, contrôlées (vérification du niveau de remplissage, test d’intégrité) puis dirigées vers le conditionnement final. Les excédents de plastique sont généralement récupérés et recyclés.
Les principaux avantages de la technologie Blow-Fill-Seal
Stérile et sans conservateurs : En intégrant la formation, le remplissage et le scellage des unidoses en un seul processus aseptique automatisé, le BFS garantit la stérilité du produit. Ce conditionnement limite les risques de contamination et supprime le besoin en conservateurs, souvent mal tolérés par les muqueuses sensibles.
Dosage précis et sécurité du patient : Le BFS garantit que chaque dose est remplie avec une quantité précise de produit, réduisant significativement le risque d’erreurs de dosage. Cela est particuliè- rement important pour les médicaments avec une posologie exacte.
Portabilité et facilité d’utilisation : Les contenants BFS sont légers, compacts et faciles à utiliser, adaptés aux modes de vie modernes.
Durée de conservation prolongée et stabilité du produit : Grâce à l’étanchéité et à la sécurité du contenant unidose formé lors du procédé BFS, la durée de conservation des produits peut être significativement prolongée. Le sachet, conçu pour un usage unique et fabriqué en matériau barrière, protège efficacement le produit de l’exposition à l’oxygène, à la lumière et à d’autres facteurs environne- mentaux susceptibles d’altérer sa qualité ou son efficacité. Ce format évite toute réutilisation, garantissant ainsi la stérilité de chaque administration. La technologie BFS, exploitée ici via le système Bottelpack© de Rommelag, contribue également à préserver les caractéristiques du produit tout au long de sa durée de vie.

Reconnu par les autorités de santé à l’échelle mondiale
La technologie BFS est utilisée à l’échelle mondiale pour la production de produits de santé en unidoses, fabriquées selon les standards requis pour chaque application : médicaments, dispositifs médicaux, cosmétiques et produits en vente libre (over-the-counter). Le processus BFS est conforme aux normes réglementaires internationales les plus strictes, telles que celles de la FDA (États-Unis) et de l’EMA (Europe).
Le polyéthylène basse densité (PEBD) utilisé pour la fabrication des unidoses est de qualité pharmaceutique, conforme aux exigences strictes de la Pharmacopée Européenne. Il est sélectionné pour sa pureté et ne contient aucun additif potentiellement nocif, tel que plastiiants, stabilisants ou colorants. Cette composition neutre et inerte garantit l’absence de migration de substances indésirables dans le produit, ce qui est essentiel pour les usages sensibles. Ce niveau d’exigence rend ces contenants particulièrement adaptés aux formulations ophtalmiques, aux traitements respiratoires comme l’asthme, ainsi qu’à toute solution stérile.
Une technologie centrée sur le patient : usage, personnalisation, observance
Personnalisation de la technologie Blow-Fill-Seal (BFS)
– La technologie BFS permet de concevoir des contenants sur mesure, aussi bien en termes de volume que de forme.
– Des embouts spécifiques peuvent être intégrés directement au moule :
⋅ Embouts pédiatriques (par exemple pour le sérum physiologique ou les traitements intranasaux).
⋅ Embouts ophtalmiques ergonomiques pour une meilleure tolérance à l’administration.
· Col Luer Lock pour la connexion directe à une seringue ou une aiguille dans le cadre de produits injectables comme Euroject®.
Le BFS permet une adaptabilité unique des formes et des embouts, pour répondre aux besoins de profils patients variés. Qu’il s’agisse d’un embout spécifique pour nourrissons destiné à l’administration de sérums physiologiques, de collyres ajustés ou d’un col Luer pour connexion à une aiguille, cette capacité d’adaptation permet d’optimiser la prise en charge en fonction des profils patients et des voies d’administration.
Son format unidose stérile et sans conservateurs garantit un usage simple et sécurisé, tout en facilitant l’observance thérapeutique.
Compatibilité avec les produits biologiques et thermosensibles
Préserver l’intégrité des biologiques : la maîtrise de la température dans la production de vaccins par technologie BFS
Dans la fabrication de vaccins et de médicaments biologiques, la stabilité des ingrédients actifs — notamment les protéines, virus vivants ou encore les ARNm — dépend de la capacité à contrôler des paramètres critiques. Parmi eux, la température joue un rôle déterminant : un excès de chaleur, même sur un court laps de temps, peut altérer l’efficacité d’une molécule.
Le procédé Blow-Fill-Seal (BFS) consiste à chauffer des granulés de polyéthylène basse densité (PEBD) à haute température, afin de former, remplir et sceller des récipients unidoses, le tout en quelques secondes. Cette température élevée pourrait paraître incompatible avec les produits biologiques et les vaccins, car une exposition prolongée pourrait altérer les structures moléculaires et compro- mettre leur efficacité. La question qui se pose alors est : le BFS a-t-il la capacité d’assurer la stabilité thermique des formulations les plus sensibles ? Comme le cycle est très rapide, l’exposition à la chaleur est considérablement réduite, ce qui permet de maintenir l’intégrité des ingrédients actifs.
Historiquement, les flacons BFS ont été utilisés avec succès comme conteneurs primaires pour les vaccins. Deux études indépendantes ont permis d’évaluer la capacité du BFS à préserver la stabilité de vaccins vivants atténués : l’une menée par MedImmune, l’autre par GSK.
– MedImmune (début des années 2010) : Réalisation d’une étude clinique de phase III comparant un vaccin antigrippal intra-nasal (MEDI8662) conditionné en BFS à FluMist®, la référence à base de flacons en verre. Les résultats ont montré que le vaccin vivant atténué BFS était immunologiquement non inférieur au vaccin de référence en flacon de verre, avec des effets indé- sirables comparables.
– Rotarix® de GSK (vaccin oral contre le rotavirus) : Conditionné en BFS pour améliorer l’accessibilité dans les pays à revenu faible ou intermédiaire (par exemple, le Myanmar). Des tests de stabilité ont confirmé que le conditionnement en BFS maintenait l’efficacité du vaccin sur 12 mois, comparable à celle des flacons en verre (Manjari et al., 2016).
Ces études confirment que le BFS ne compromet pas l’efficacité ou la stabilité des vaccins, même pour les produits biologiques sensibles à la température.
Étude de cas – Euroject® : Maîtrise thermique et compati- bilité biologique d’un dispositif BFS unidose, cas d’un vaccin pour le SARS-CoV-2
Unither Pharmaceuticals a mené plusieurs tests avec le dispositif Euroject®, qui ont démontré qu’un encadre- ment rigoureux du procédé BFS permet de préserver l’intégrité des substances actives. Cette démarche repose sur une combinaison fine d’ingénierie, de surveillance en temps réel et d’analyses en aval.
Limiter l’exposition thermique : des leviers techniques maîtrisés
Plusieurs stratégies de refroidissement permettent de contrôler la température au cœur du cycle de remplissage :
– Réfrigération de la solution vrac à 5°C avant remplissage ;
– Moules et aiguilles refroidis, rédui- sant la diffusion thermique lors du remplissage ;
– Système cooIBFS (Rommelag), permettant de lisser les pics de chaleur et de réduire le temps d’exposition.
Des indicateurs thermochromes ont confirmé que la température ne dépas- sait pas 40°C pour 90% des 0,5 mL de la dose testée. En moins de dix minutes, la température des doses redescend entre 20 et 25°C.
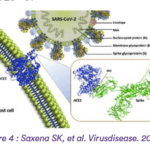
Un test a été réalisé avec le cas d’un vaccin pour le SARS-CoV-2. L’antigène vaccinal est un dimère du domaine de liaison au récepteur (RBD) du SARS-CoV-2, correspondant aux séquences 319–541 de la protéine spike. Il est produit dans des cellules CHO (ovaires de hamster chinois) génétiquement modifiées, avec stabilisation par un pont disulfure interchaîne Cys538-Cys538.
Chaque dose de 0,5 mL contient 10 μg d’antigène RBD.
La distribution d’un lot de 3 L (équivalent à 60 mg d’antigène) dans des flacons BFS unidoses remplis à 0,5 mL a été réalisée en seulement 6 minutes et 53 secondes, illustrant l’efficacité du procédé.
Plusieurs approches analytiques complémentaires ont été utilisées aux différentes étapes du processus (Table 1).
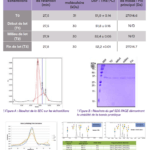
A) Analyse par chromatographie d’exclusion stérique (SEC)
La chromatographie d’exclusion stérique a été utilisée pour évaluer la taille et l’homogénéité de la protéine en solution. Les profils obtenus aux différents temps de prélèvement (T0, T1, T2, T3) sont similaires, avec des temps de rétention (Rt) compris entre 27,5 et 27,9 minutes. Le pic du monomère est prédominant dans tous les cas, sans détection de fragmentation ni de formation d’agrégats. Ces résultats indiquent que la structure de la protéine reste stable tout au long du procédé BFS.
B) Analyse SDS-PAGE sur gel à 15 %
La migration sur gel SDS-PAGE, permettant d’estimer la masse moléculaire appa- rente des protéines, montre des bandes identiques (~30–31 kDa) aux différentes phases de la production (début, milieu, fin). Aucune dégradation ni agrégation n’est observée, confirmant la stabilité de la protéine lors du remplissage en BFS.
C) Stabilité thermique par Nano-DSF et analyse du profil de glycosylation
La stabilité tridimensionnelle de la protéine a été étudiée à l’aide de deux approches complémentaires : la Nano-Differential Scanning Fluorimetry (Nano-DSF) et la spectrométrie de masse (LC-MS) après réduction et déglycosylation enzymatique par PNGaseF.
L’analyse Nano-DSF permet de mesurer la température de dépliement de la molécule (Tma) via les variations de fluorescence intrinsèque. Les profils de dépliement (dérivées premières du ratio de fluorescence) pour les quatre échantillons (T0, T1, T2, T3) sont superposables, avec les températures suivantes :
-T0:51.9±0.14°C -T1:51.8±0.16°C -T2:52.4±0.05°C -T3:52.2±0.01°C
Ces résultats confirment l’absence d’effet du procédé BFS sur la stabilité thermique de l’antigène.
La spectrométrie de masse (LC-MS) après réduction et déglycosylation enzymatique (PNGaseF) : les spectres déconvolués des échantillons T0 et T3 montrent des glycoformes identiques, incluant Hex, HexNAc et NeuAc. Les faibles écarts entre les masses observées et théoriques confirment la stabilité du profil de glycosylation.
Aucun impact du procédé BFS sur la structure du vaccin sous-unitaire n’a été observé :
– Les caractéristiques biochimiques sont intégralement conservées.
– L’activité fonctionnelle (non montrée ici) est également préservée.
Vers une compatibilité avec les vaccins à ARNm
Les applications aux vaccins à ARNm, bien que non encore validées à grande échelle via BFS, laissent entrevoir un potentiel prometteur. Des travaux préliminaires sur certains ARNm (notamment dans le cas de vaccins expérimentaux contre la rage) ont montré une stabilité thermique jusqu’à 70°C sur trois mois. Sachant que le BFS maintient l’ARNm en deçà de 40°C, son utilisation pourrait être élargie, sous réserve de tests complémentaires. Des recherches supplémentaires restent nécessaires pour valider cette compatibilité à grande échelle.
Chaîne du froid : résistance à la congélation
La robustesse des flacons en PEBD a également été validée dans des conditions extrêmes de stockage : trois cycles de congélation/décongélation à -80°C ont confirmé l’absence de changement significatif en termes de propriétés mécaniques ou chimiques. Ces résultats ont été obtenus via :
– Calorimétrie différentielle à balayage (DSC)
– Spectroscopie FTIR
– Analyse mécanique dynamique (DMA)
– Microscopie et indice de fluidité
Grâce à la maîtrise de la température, la technologie BFS s’impose désormais comme une solution de remplissage fiable pour les médicaments thermosensibles. Son efficacité, sa vitesse et sa capacité à s’adapter aux chaînes du froid en font un outil stratégique, notamment dans un contexte de production de vaccins à grande échelle ou de rupture de stocks de flacons en verre.
Comme le souligne Alexandre Fontayne, directeur scientifique des produits biologiques chez Unither : Ces avancées ouvrent la voie à “l’utilisation de cette technologie pour le stockage et l’administration de produits biologiques sous forme d’unidoses – qu’il s’agisse de vaccins, d’anticorps, de facteurs de coagulation ou de traitements comme les agonistes GLP-1.”
Une technologie pensée pour l’usage terrain et l’équité en santé
Au-delà de l’aspect technique, la technologie Blow-Fill-Seal dans l’application d’administration de biologiques incarne une véritable approche patient-centric en facilitant l’accès, l’administration et la sécurité des traitements :
– Simplicité d’administration : le geste d’injection avec l’unidose est opéré par une seule pression pour délivrer la dose de médicament, le tout sans manipulation complexe. Cette facilité d’utilisation permet à la technologie BFS de s’adapter à l’auto-ad- ministration, à des situations où les ressources en personnels de santé sont limitées, ou encore en cas de formation médicale insuffisante.
– Retours positifs des professionnels de santé : Une étude menée en 2021 par Unither auprès de 427 professionnels de santé en France, au Royaume-Uni et en Italie (médecins généralistes, pharmaciens et infirmiers) met en évidence une perception positive du dispositif Euroject®. Jugé inno- vant par 80 % des répondants, il est également reconnu pour sa facilité d’utilisation (74%) et de stockage (73 %). Les professionnels soulignent un gain de temps significatif (73 %) ainsi que la simplicité de la préparation — ouverture de la dose, fixation de l’aiguille — et de l’administration, possible en une seule pression pour 0,5 mL. Cette facilité d’usage en fait un outil adapté à une large variété de contextes cliniques.
– Accessibilité et sécurité en zones sensibles : la robustesse des ampoules en plastique (pas de casse comparé au verre), leur légèreté et leur format compact sont adaptés aux campagnes de vaccination, les contextes humanitaires ou les soins ambulatoires. Le faible risque de contamination croisée et le conditionnement stérile garantissent une sécurité maximale pour les patients et les praticiens de santé qui accomplissent les gestes médicaux.
– Amélioration de l’observance : l’utilisation d’unidoses prêtes à l’emploi, sans conservateurs et dotées d’un design ergonomique, facilite le traitement quotidien et favorise la régularité des prises, pour les enfants ou les personnes âgées.
Ce dispositif, centré sur l’utilisateur final — qu’il s’agisse d’un professionnel de santé ou d’un patient —, est simple, sécurisé et favorise l’équité d’accès.
Applicables à diverses aires thérapeutiques, pour des solutions centrées sur le patient
Grâce à son attribut stérile, la technologie BFS est déployée dans plusieurs aires thérapeutiques :
Ophtalmologie
– Glaucome : collyres contenant des principes actifs tels que le Timolol et les prostaglandines et analogues, utilisés pour abaisser la pression intraoculaire.
– Syndrome de l’œil sec : larmes artificielles sans conservateur à base de Hyaluronate de sodium et de Carboxyméthylcellulose, destinées à la lubrification de la surface oculaire.
– Conjonctivite allergique : collyres contenant des antihistaminiques tels que le Kétotifène et l’Olopatadine, utilisés pour le traitement symptomatique.
– Conjonctivite bactérienne : collyres à base d’antibiotiques tels que la Ciprofloxacine et la Tobramycine, utilisés pour le traitement des infections d’origine bactérienne.
– Affections post-chirurgicales et inflammatoires : collyres contenant des corticoïdes tels que l’hydrocortisone et la Dexaméthasone, indiqués pour le contrôle de la réponse inflammatoire.
ORL (Oto-Rhino-Laryngologie)
– Hygiène nasale et sinusale : sérum physiologique en unidoses stériles pour le lavage et l’hydratation des fosses nasales, utilisé dans le cadre de pathologies telles que la rhinite et la sinusite.
– Soins pédiatriques : sérum physio- logique stérile sans conservateur, utilisé chez les nourrissons et jeunes enfants pour la décongestion nasale et l’élimination des sécrétions.
Voies respiratoires
– Asthme : solutions pour nébulisation contenant des bronchodilatateurs et des corticoïdes inhalés, utilisées pour réduire l’inflammation bronchique et la bronchoconstriction.
– Maladie Pulmonaire Obstructive Chronique (MPOC) : formulations à base de mucolytiques et d’antiinfectieux administrées par voie inhalée, utilisées pour faciliter l’expectoration et prévenir les infections.
– Mucoviscidose : solutions pour nébulisation contenant des antibiotiques et des vasodilatateurs, utilisées dans la prise en charge des infections respiratoires chroniques.
BFS et durabilité
Circularité et mono-matériaux
L’usage du polyéthylène basse densité (PEBD) s’inscrit dans le mouvement vers une production durable. Ce mono-matériau, absent d’additifs problématiques telles que les plastifiants ou le bisphénol, est simple à recycler alors qu’il garde sa souplesse et sa résistance. L’impact environnemental est résolument atténué par l’absence de verre et de composants métalliques, par la réduction de l’exploi- tation de ressources naturelles comme le sable dont la consommation globale à travers le monde est de 50 milliards de tonnes par an* et la réduction de la consommation énergétique.
Étude de cas :
Sur le site d’Unither à Gannat (France), les chutes de PEBD en cours de production sont recyclées en boucle fermée sous forme de granulés, diminuant les déchets tout en préservant les propriétés techniques des unités BFS.
Résultats clés de l’initiative d’Unither Industries (Gannat, France) :
1. Réduction de l’empreinte carbone : Le programme de recyclage a permis de réduire les émissions de CO2 EQ par tonne de PEBD produit de près de deux tiers.
2. Amélioration de la gestion des déchets : L’initiative soutient la stratégie d’économie circulaire d’Unither en transformant les déchets en une ressource réutilisable dans le cycle de production.
3. Amélioration des indicateurs de durabilité : Grâce à l’utilisation de PEBD recyclé, les opérations de Gannat ont vu une réduction des externalités négatives sur plusieurs critères environnementaux, permettant ainsi de s’aligner sur les objectifs de durabilité globaux d’Unither.
Laury Livemont, Responsable du Développement Thérapeutique & Innovation Industrielle, déclare : “Chez Unither, nous avons choisi d’utiliser le PEBD pour nos contenants BFS en raison de ses propriétés uniques, telles que la flexibilité et la résistance chimique, ce qui en fait un choix idéal pour maintenir l’intégrité des produits sur une large plage de températures, notamment pour les produits sensibles tels que les solutions ophtalmiques, les traitements respiratoires et les injectables. De plus, le PEBD est léger, résistant aux chocs et offre d’excellentes propriétés barrières, améliorant la durabilité de nos emballages durant le transport et la manutention.”
Éco-conception et innovation continue
L’éco-conception est dès aujourd’hui intégrée au développement des formats BFS, en optimisant le poids et la quantité de plastique utilisée tout en anticipant leur recyclabilité. L’automatisation des lignes BFS, avec un processus en ligne fermé et continu, réduit les besoins en machines, en énergie et en matériaux annexes, tout en minimisant les déchets liés aux rebuts de production.
Des recherches sont en cours pour intégrer des polymères biosourcés issus de matières renouvelables comme la canne à sucre. L’objectif est de garantir les mêmes performances barrières tout en améliorant encore l’empreinte environnementale du BFS. Cette dynamique s’ins- crit dans une stratégie RSE globale, avec un bilan carbone réalisé annuellement sur tous les sites d’Unither et des objectifs de réduction des émissions à l’horizon 2030, en cohérence avec les accords de Paris (COP21). Comme le souligne Alexandre Ivain, notre Chef de Projet RSE : “Notre vision de l’éco-conception et de la RSE dans l’industrie pharmaceutique permet d’allier innovation et responsabilité.”
La technologie Blow-Fill-Seal (BFS) s’impose comme une réponse concrète aux enjeux de durabilité dans la fabrication pharmaceutique. Elle offre plusieurs avantages clés :
– Réduction des déchets : Le conditionnement des unidoses en système fermé permet de minimiser les pertes de matières premières et de limiter les risques de contamination, réduisant ainsi le gaspillage global sur la ligne de production.
– Recyclabilité des matériaux : Les polymères employés (polyéthylène basse densité, haute densité, polypropylène) sont des monomatériaux entièrement recyclables. Leur homogénéité simplifie la gestion des déchets et favorise l’économie circulaire.
– Efficacité énergétique : L’automatisation complète du processus BFS limite les manipulations humaines et optimise la consommation d’énergie par rapport aux technologies traditionnelles, contribuant ainsi à une empreinte carbone réduite.
– Responsabilité environnementale : De plus en plus d’entreprises intègrent la mesure des émissions carbone dans leurs critères de performance, s’appuyant sur des outils de pilotage pour rationaliser leur usage de l’eau, de l’énergie et des matières premières.
– Formulations durables : Le BFS facilite la production sans conservateurs, particulièrement importante en ophtalmologie.
– Éco-conception intégrée : Le BFS s’inscrit dans une approche de cycle de vie du produit, encourageant l’utilisation de matériaux durables dès la phase de conception et stimulant la collaboration entre R&D, production, qualité et développement durable.
Conclusion : Le BFS, une technologie tournée vers l’avenir
Le procédé Blow-Fill-Seal (BFS) est une technologie de remplissage aseptique entièrement automatisée, utilisée dans l’industrie pharmaceutique depuis plus de 50 ans. Fonctionnant en système fermé, il permet la formation, le remplissage et le scellage des contenants en une seule séquence, sans contact humain. Cette configuration réduit fortement les risques de contamination et garantit la stérilité du produit final.
Le BFS présente plusieurs avantages techniques majeurs puisqu’il élimine le besoin de conservateurs grâce à un conditionnement unidose hermétique, assure un dosage précis, essentiel pour les médicaments à posologie critique, et permet la fabrication de formats compacts, légers et robustes, adaptés à une utilisation nomade ou ambulatoire.
Son adaptation aux exigences des produits biologiques thermo-sensibles a été démontrée par des études incluant des vaccins à base de protéines re-combinantes. Les résultats montrent que l’intégrité moléculaire, thermique et fonctionnelle des antigènes est conservée tout au long du cycle BFS. Cette capacité ouvre la voie à de nouvelles applications, y compris dans le domaine des vaccins à ARNm, sous réserve de validations complémentaires.
Enfin, le BFS s’intègre dans une démarche de durabilité industrielle. L’utilisation de monomatériaux recyclables comme le polyéthylène basse densité (PEBD), les circuits de recyclage en boucle fermée, ainsi que l’éco-conception des emballages contribuent à réduire l’impact environnemental du procédé.
Ainsi, le BFS combine rigueur scienti- fique, efficacité industrielle et responsa- bilité environnementale, répondant aux attentes d’une industrie pharmaceutique en pleine transformation.
Glossaire
BFS Blow Fill Seal
BP BottelPack
PEBD Polyéthylène Basse Densité
FDA Food and drugs Administration
EMA European Medicines Agency
ANVISA Agência Nacional de Vigilância Sanitária
OTC Over The Counter
SEC Size Exclusion Chromatography
SDS-PAGE Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis
MS Mass Spectrometry
NANO-DSF Nano-Differential Scanning Fluorimetry PNGASEF Peptide: N-Glycosidase F
LC-MS Liquid Chromatography-Mass Spectrometry DSC Differential Scanning Calorimetry
FTIR Fourier Transform Infrared Spectroscopy DMA Dynamic Mechanical Analysis
ORL Oto-Rhino-Laryngologie
MPOC Maladie Pulmonaire Obstructive Chronique ARNM Acide RiboNucléique messager
ODD Objectifs de Développement Durable
Références
– Manjari SK, et al. (2016). Vaccine. DOI: 10.1016/j. vaccine.2016.03.082.
– Saxena SK, et al. (2020). VirusDisease. DOI: 10.1007/ s13337-020-00568-9.
– Unither Pharmaceuticals. Étude qualitative auprès de 427 professionnels de santé (2021) https://infos. unither-pharma.com/euroject-study
– European Biotechnology. Blow-Fill-Seal technology and vaccine delivery (2021) www.european- biotechnology.com/background/blow-fill-seal- technology-and-vaccine-delivery/
– FDA. Guidance for Industry: Sterile Drug Products Produced by Aseptic Processing — Current Good Manufacturing Practice (2004) https://www.fda.gov/ media/ 7 1026/download
– EMA. Guideline on Plastic Immediate Packaging Materials (2005) https://www.ema.europa.eu/en/ documents/scientific-guideline/guideline-plastic- immediate-packaging-materials_en.pdf
– Sheldon EA, et al. (2013). Influenza Other Respir Viruses. DOI: 10.1111/irv.12027.
– Rommelag. coolBFS Technology (2025) www. rommelag.com/en/technology/blow-fill-seal
– Sharma R, et al. (2023). Vaccines. DOI: 10.3390/ vaccines11101587.
– Leonard, La Fabrique de la Cité. Construire avec le sable du désert ? (2025) https://leonard.vinci.com/ finite-construire-avec-le-sable-dudesert/
– Gavi, the Vaccine Alliance. Technical Note: Blow- Fill-Seal Primary Containers (2020). https://www. gavi.org/sites/default/files/about/market-shaping/ Phase-I/3_VIPS%20Phase%20I_Technical%20Note%20 Blow%20Fill%20Seal%20Primary%20Containers.pdf
– Patel P, et al. (2024). Journal of Pharmaceutical Sciences. DOI: 10.1016/j.xphs.2023.11.015.
– ANVISA. Resolução RDC no 111/2016. https://www. gov.br/anvisa/pt-br/setor-regulado/legislacao/ medicamentos/2016/resolucao-rdc-no-111-de-15-de- setembro-de-2016.pdf
– Pharmacopée Européenne. Matériaux et récipients dans la 10e Édition de la Ph. Eur. (2018). https://urlr. me/n7Jz3s
Partager l’article





