Sommaire
- Point de vue de la direction de l’inspection (DI) de l’ANSM sur le document ICH Q12
- ICH Q12 : les fondamentaux. Retours des travaux du GIC A3P ICH Q12
- First steps towards ICH Q12: Leveraging process understanding & development data to define process Established Conditions
- ICHQ12 Implementation from an Industry Perspective with a Focus on Established Conditions
- ICH Q12 compliance and Unified Quality and Regulatory Information Management
- Burkholderia cepacia a encore frappé
- Nouveau guideline Stérilisation de l’EMA
- How to store highly sensitive drugs? The benefit of functional coatings
Point de vue de la direction de l’inspection (DI) de l’ANSM sur le document ICH Q12
Cet article présente le point de vue de la direction de l’inspection (DI) de l’ANSM sur le document ICH Q12 très récemment adopté à Singapour lors de la dernière réunion de l’assemblée ICH. Il détaille les éléments clés du texte ayant un impact sur les bonnes pratiques de fabrication (BPF), l’inspection et l’industrie. Il montre quelques éléments statistiques dans le champ d’ICH Q12 et les besoins de communication. Il souligne enfin les challenges à venir pour sa mise en oeuvre.
1. Quelques mots d’introduction
ICH Q12 :
– concerne le cadre des fameux “CMC” (chimie/Chemistry-fabrication/Manufacturing – contrôles/Controls),
– décrit des considérations techniques et réglementaires pour la gestion du cycle de vie des produits pharmaceutiques,
– promeut “une approche harmonisée qui devrait profiter aux patients, à l’industrie et aux autorités compétentes en favorisant l’innovation et l’amélioration continue du secteur pharmaceutique, en renforçant l’assurance de la qualité et en améliorant l’offre de médicaments”,
– s’insère avec les autres lignes directrices que sont ICH Q8, Q9, Q10 et Q11,
– vise donc essentiellement les variations d’autorisation de mise sur le marché (AMM) et les évaluateurs des autorités compétentes en matière de délivrance de ces autorisations.
ICH Q12 indique que :
– un système de management de qualité (SMQ) pharmaceutique efficace tel que décrit dans ICH Q10 et la conformité aux BPF régionales sont nécessaires pour tirer pleinement parti de ce document. En particulier, la gestion des changements dans la chaîne de fabrication est un élément essentiel d’un SMQ efficace,
– les rôles de l’évaluation et de l’inspection au sein des autorités compétentes sont complémentaires dans la surveillance des modifications post-AMM,
– le maintien d’un SMQ efficace relève de la responsabilité de l’industrie (sites de fabrication et titulaire d’AMM, le cas échéant),
– l’objectif n’est pas d’exiger une inspection spécifique évaluant l’état du SMQ avant que l’industrie puisse utiliser les principes d’ICH Q12,
– il est entendu qu’un site de fabrication peut être considéré, d’une manière générale, comme conforme aux BPF tout en nécessitant des mesures préventives ou correctives à la suite d’une inspection, sans forcément utiliser des suites administratives de type injonction,
– au cas où de telles lacunes auraient une incidence sur l’efficacité de la gestion du changement dans le SMQ, il pourrait en résulter des restrictions sur la capacité d’utiliser la flexibilité prévue par ICH Q12,
– les responsabilités du fabricant et du titulaire d’AMM sont clairement établies et visent :
• toutes les parties prenantes de la chaine de fabrication d’un médicament qui doivent interagir pour utiliser efficacement les connaissances et gérer les changements tout au long du cycle de vie d’un produit,
• elles doivent gérer la communication d’informations et les interactions des SMQ de ces différentes parties prenantes (internes et externes à une entreprise).
– en termes de communication, ces responsabilités couvrent les points suivants :
• les modifications apportées aux « conditions établies » (Established Conditions/ EC) doivent être communiquées rapidement entre le titulaire d’AMM et les autorités compétentes, ainsi qu’entre ce titulaire et toute la chaîne de fabrication (et inversement),
• la rapidité de la communication est à définir en fonction de l’impact de tout changement lié aux EC et doit être ciblée sur les entités de la chaîne qui doivent être informées du changement pour le mettre en œuvre tout au long du cycle de vie du produit concerné,
• la structure responsable de la libération des lots doit être informée de tous les changements pertinents et, le cas échéant, participer à la prise de décision (rôle du pharmacien responsable en France),
• les mécanismes de communication concernant les modifications du dossier d’AMM et les déviations aux BPF doivent être définis dans la documentation pertinente, y compris dans les contrats avec les sous-traitants,
• une défaillance critique d’un SMQ à n’importe quel point de la chaîne de fabrication peut avoir un impact sur la capacité à utiliser les avantages d’ICH Q12. Par conséquent, les responsables doivent communiquer sur ces défaillances critiques avec les autorités compétentes concernées.
– les responsabilités des autorités compétentes sont focalisées sur :
• la communication entre inspecteurs et évaluateurs (rien de nouveau dans ce qui est décrit),
• la communication est encouragée entre les autorités compétentes de toutes les régions, conformément aux accords bilatéraux / multilatéraux appropriés. Par exemple, la communication de défaillances critiques du SMQ d’un composant de la chaine de fabrication et susceptible d’affecter l’utilisation d’ICH Q12 dans le cycle de vie d’un produit.
Deux points clés ont été retenus par la DI :
– la maturité du SMQ,
– la communication entre opérateurs et autorités compétentes, entre inspecteurs et évaluateurs et entre autorités compétentes.
Quels sont les constats aujourd’hui dans ces deux domaines ?
2. Quelques données statistiques BPF dans le champ concerné par ICH Q12
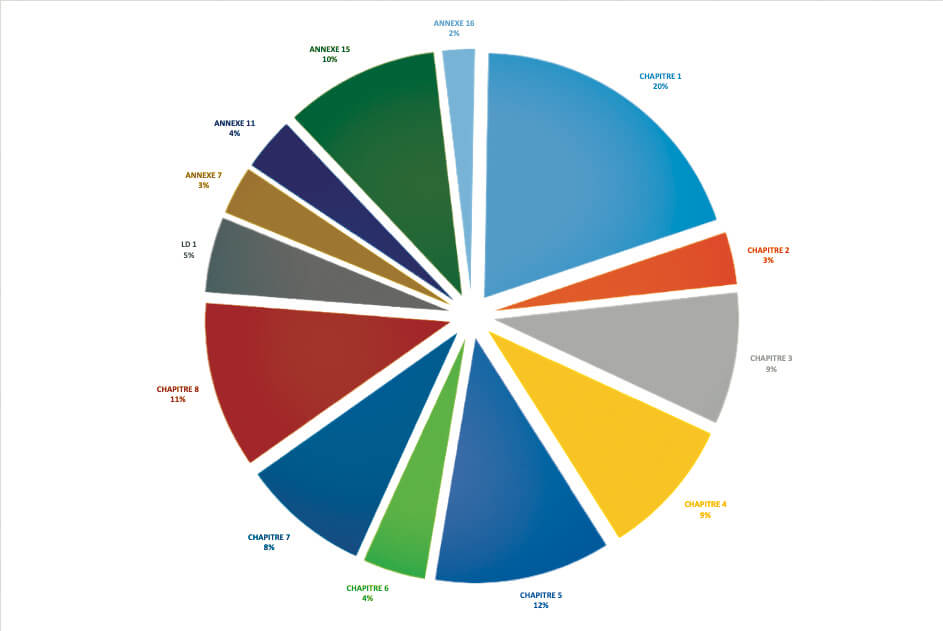
Pour l’ANSM, en 2018 et dans le domaine du médicament, il apparait que 20% des écarts critiques ou majeurs (850 relevés au cours des inspections) concernent le chapitre 1 des BPF et donc relève du SMQ (voir graphique page précédente).
Pour l’agence irlandaise (HPRA) et en ce qui concerne les écarts majeurs, le premier de la liste est le SMQ qui revient dans 40 % des inspections. La gestion des déviations est très souvent citée. Ce chiffre arrive aussi en premier pour les écarts « autres » à un niveau proche de 25 %.
Pour l’agence britannique (MHRA) et sur 820 inspections BPF menées entre le 1er janvier 2018 et le 10 septembre 2019, les écarts critiques relevés sont au nombre de 41 et de 676 pour les écarts majeurs au regard des paragraphes spécifiques au SMQ du chapitre 1. Si on se réfère à l’annexe 15 du guide des BPF (qualification et validation), la MHRA relève 43 écarts majeurs dans le seul domaine de la gestion des changements.
Enfin, pour le PIC/S, entre 2011 et 2016, selon les données recueillies auprès d’une quarantaine d’autorités compétentes, les écarts relatifs au SMQ sont ceux les plus cités dans les rapports d’inspection.
3. La communication entre les parties prenantes
Il existe des canaux de communication entre autorités compétentes mais, à l’heure actuelle, aucun n’existe pour gérer spécifiquement le domaine du SMQ. Dans le domaine des BPF, des mécanismes de communication existent :
– entre les opérateurs et les autorités compétentes, pour les défauts qualités,
– entre les autorités compétentes (y compris entre inspecteurs et évaluateurs), pour les défauts qualité et la gestion des non-conformités BPF. Bien qu’ils soient efficaces, ils sont limités à certaines enceintes comme l’Union européenne (et l’accès à sa base EudraGMDP), le PIC/S ou l’OMS pour les défauts qualité.
De nouveaux systèmes sont donc à envisager pour la gestion des SMQ d’établissements situés dans des pays comme la République Populaire de Chine (RPC) et l’Inde qui sont aujourd’hui absents des réseaux BPF.
4. Conclusion
Le texte vient d’être adopté. C’est donc le début de la phase la plus délicate, à savoir la mise en œuvre du texte par toutes les parties prenantes ICH et notamment les autorités compétentes.
Quelques challenges sont à venir et notamment quel sera le calendrier de déploiement ? Sera-t-il coordonné pour permettre une utilisation optimale et harmonisée par l’industrie ?
Le document devrait maintenant indiquer qu’ il est demandé aux autorités compétentes membres d’ICH de fournir des informations publiquement disponibles, de préférence sur leur site internet, sur la mise en œuvre d’ICH Q12 dans leur région, en particulier en ce qui concerne les considérations réglementaires,
– au niveau européen, quel est l’impact de ce texte sur la réglementation des variations ? Et sur le financement des agences dont le budget est lié au dépôt des demandes correspondantes ?
– y aura-t-il nécessité à modifier le guide des BPF ?
– si le texte ICH dit qu’au cas où des écarts critiques aux BPF pouvaient avoir une incidence sur l’efficacité de la gestion du changement dans le SMQ, il pourrait en résulter des restrictions sur la capacité d’utiliser la flexibilité prévue par ICH Q12. Ceci pourrait être étendu au fait que les changements intervenus depuis la dernière inspection constatant le bon fonctionnement du SMQ pourraient être remis en cause (système analogue à ce qui se passe pour les bonnes pratiques de laboratoire/ BPL) ?
– quelle formation va être mise en place au niveau ICH pour les autorités compétentes et l’industrie ? Et selon quelles modalités ?
En Europe, quels moyens seront mis à la disposition des personnes qualifiées (pour la France : les pharmaciens responsables) pour démontrer l’existence d’un SMQ robuste tout au long de la chaine de fabrication d’un médicament ?
Quels nouveaux outils de communication vont être définis entre l’industrie et les autorités compétentes ainsi qu’entre ces mêmes autorités, tout au long de la chaine de fabrication et du cycle de vie d’un médicament ? Ces outils devront comprendre des acteurs clés comme la RPC et l’Inde. Une structure comprenant uniquement des autorités compétentes (IPRP) pourrait mener une réflexion en ce sens.
En fait, la vraie vie d’ICH Q12 ne fait donc que commencer.
Partager l’article

Jacques Morénas – ANSM
Jacques Morénas a travaillé plus de 40 ans dans différentes structures du ministère chargé de la santé et notamment à la direction de l’inspection de l’ANSM pendant 25 ans. Il est actuellement conseiller technique du directeur de l’inspection. Il a participé à la rédaction des documents ICH Q9, Q10 et Q12. Il est aussi membre du bureau exécutif du PIC/S en qualité de président du sous-comité formation.
Glossaire
AMM : Autorisation de Mise sur le Marché
ANSM : agence nationale de sécurité du médicament et des produits de santé (www.ansm.sante.fr),
HPRA : Health Products Regulatory Authority (www.hpra.ie)
ICH : International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (www.ich.org),
IPRP : International Pharmaceutical Regulators Programme ( www.iprp.global/home),
MHRA : Medicines and Healthcare products Regulatory Authority (www.gov.uk),
OMS : Organisation Mondiale de la Santé (www.who.int),
PIC/S : Pharmaceutical Inspection Cooperation Scheme (www.picscheme.org).




