Sommaire
- Produits Combinés Injectables. Enjeux et challenges pour les industriels.
- Extension des délais ou non, ce que les fabricants de Classe I doivent retenir.
- Les nouveaux défis des médicaments injectables.
- L’investigation clinique des dispositifs médicaux combinés dans le cadre du nouveau règlement (UE) 2017/745 (RDM).
- Apport de la caractérisation physico-chimique des matériaux constitutifs des dispositifs médicaux pour une rationalisation de leur évaluation biologique.
- Piloter la performance des validations de nettoyage : un enjeu industriel fort.
- Validation des procédés de nettoyage : pourquoi et comment valider les méthodes analytiques et de prélèvements associées.
- Maintenance des équipements en acier inoxydable dans un environnement de fabrication conforme aux BPF : une approche basée sur les risques.
- Single Use Systems vs Re-Usable Stainless-Steel Equipment. Compliance & Quality Perspective.
Produits Combinés Injectables. Enjeux et challenges pour les industriels.

Historiquement, le développement de produits combinés injectables a été porté par des aires thérapeutiques comme le diabète, les hormones de croissance, les anticoagulants ou les vaccins dans lesquelles des solutions en stylo injecteur ou seringues préremplies ont fait preuve de leur efficacité et de leur adhésion par les patients et professionnels de santé.
Ces dernières années, l’industrie pharmaceutique a focalisé ses efforts de R&D sur de nouvelles entités biologiques (e.g. protéines thérapeutiques, anticorps monoclonaux) pour le traitement du cancer ou de pathologies chroniques inflammatoires, auto-immunes, cardiovasculaires ou neurologiques. Les produits ont été mis sur le marché non plus pour une administration par voie intraveineuse à l’hôpital par un professionnel de santé mais par voie sous cutanée afin de permettre une auto administration par les patients à domicile.
L’enjeu pour les industriels est d’apporter des solutions centrées sur les besoins du patient, améliorant l’efficacité, la sécurité et la tolérance des traitements avec un coût global de prise en charge maitrisé.
1. Un cadre règlementaire complexe et évolutif
Les produits tels que les seringues préremplies ou les stylos injecteurs comportent à la fois une solution médicamenteuse et un dispositif médical dont les périmètres respectifs sont bien définis dans les textes réglementaires. Cependant, lorsque l’on s’intéresse à l’association de ces deux éléments, les définitions de « produits combinés » ne semblent pas harmonisées dans les textes de référence.
Aux Etats-Unis, le terme “Combination Products” est défini dans le 21 CFR 3.2 et comprend trois cas classiques : un produit composé d’au moins deux composants mélangés et commercialisé en une seule entité, les produits co-packagés dans un kit et les produits emballés séparément mais dont les étiquetages spécifient une utilisation commune pour atteindre l’effet recherché (Produits cross-étiquetés). Le service de la FDA dédié aux produits combinés, l’OCP, oriente les produits vers le service d’évaluation concerné (CDER/CBER pour les médicaments, CDRH pour les dispositifs médicaux) en fonction du mode d’action principal du produit (PMOA).
En matière d’exigences de système qualité pour un produit combiné injectable, les textes principaux suivants s’appliquent : le 21 CFR Part 210 & 211 (pour la partie médicament) et le 21 CFR Part 820 (pour la partie dispositif médical).
Deux approches sont alors possibles, soit l’élaboration d’un système en compliance totale avec les référentiels applicables pour chaque constituant du produit combiné, soit une approche rationnalisée basée sur une compliance complète au cGMP “Drug” et intégrant les éléments spécifiques du système qualité du dispositif médical (maîtrise de la conception et développement, maîtrise des achats, responsabilités de la direction, CAPA, prestations associées, activités installation).
Au niveau européen, le statut de produit combiné n’est pas défini. Il est soit Dispositif Médical soit Médicament. Les éléments permettant de statuer sur le produit sont présents à l’article 1 du nouveau règlement européen 2017/745 relatif aux dispositifs médicaux. Dans le cas où le dispositif intègre une substance médicamenteuse dont l’action est accessoire par rapport au dispositif médical, le produit est réglementé comme un DM. Au contraire, si le dispositif est destiné spécifiquement à supporter la substance médicamenteuse le produit est réglementé par la directive 2001/83/CE relative aux médicaments.
En juin 2019, l’EMA a publié une ligne directrice sur les produits combinés en draft pour consultation dans l’optique de préciser et d’harmoniser les requis réglementaires pour ces produits dans les modules 1 et 3 des dossiers d’AMM. La définition de produit combiné rejoint l’approche de la FDA en distinguant les combinaisons médicament/dispositifs en “produit intégral” (comprendre “une seule entité”) et “produit non-intégral” (co-packagés ou cross-étiquetés).
Pour un “produit non-intégral” tel qu’un stylo injecteur rechargeable ou une pompe d’infusion sous-cutanée, la partie DM doit donc être marquée CE selon le règlement 2017/745 en appliquant les requis des classes IIa ou IIb (Article VIII – règle 12) avec l’implication d’un organisme notifié dans le processus de certification. Le fabricant devra donc prendre en compte l’impact de ce nouveau règlement et le renforcement des exigences, notamment en ce qui concerne l’évaluation clinique, la traçabilité renforcée par la mise en place de l’identifiant unique des dispositifs médicaux (UDI) et la surveillance après mise sur le marché.
Dans le cas d’un système d’administration prérempli, le produit combiné sera réglementé comme un médicament soumis à la directive 2001/83/CE, le dispositif d’injection devant respecter tout de même les exigences essentielles en matière de sécurité et performance présentées dans l’annexe 1 du règlement 2017/745 et les inclure au dossier d’AMM conformément à l’article 117 de ce règlement.
2. Des enjeux organisationnels, culturels et humains
Dans ce contexte d’évolution majeure de l’environnement marché et règlementaire, les industriels sont confrontés à de nouveaux enjeux organisationnels, culturels et humains autour de la gestion du cycle de vie de leurs produits.
Les différences de référentiels, systèmes de management, compétences, langages techniques et terminologies sont autant de challenges et de défis à relever pour maitriser les délais de mise sur le marché et la qualité des produits commercialisés.
Une approche organisationnelle intégrée combinant les exigences applicables au cycle de vie d’un médicament et de son dispositif d’administration doit être mise en place, supportée par un système qualité et des méthodologies robustes permettant d’adresser une gestion proactive des risques inhérents à la mise sur le marché de produits d’une complexité élevée, répondant à des besoins et à des risques patients élevés.
Ainsi, les produits combinés intégrant un dispositif d’administration doivent être développés en accord avec les requis de la règlementation du médicament mais doivent également intégrer la maitrise de la conception (« design control »), la gestion des risques et l’aptitude à l’utilisation du dispositif.
Cette approche intégrée suppose que les spécificités liées au dispositif d’administration et ses constituants soient prises en considération suffisamment tôt et de manière itérative dans le processus de développement du produit combiné, système complexe dans lequel les interactions entre les différents constituants et sous-systèmes sont critiques pour l’obtention des performances cliniques et la sécurité du patient.
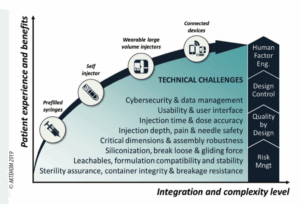
3. Des challenges techniques et méthodologiques pour une expérience patient optimale
Les besoins des patients en termes de sécurité et d’efficacité du traitement mais également d’expérience utilisateur amènent
les industriels à développer des solutions de plus en plus intégrées et complexes, chaque génération de produit combiné apportant son lot de bénéfices mais également de challenges techniques et de risques associés.
Dès les premiers stades du développement, les industriels font face à des problématiques d’interaction entre la formulation, le conditionnement primaire et le dispositif d’administration et, au-delà de l’expertise technique, la mise en œuvre efficace des processus de management des risques, de Quality by Design et de Design Control est essentielle pour assurer la mise sous contrôle de la qualité et de la sécurité d’utilisation des produits combinés.
Une vigilance particulière doit être apportée aux risques de compatibilité entre la formulation et les articles de conditionnement primaire notamment vis-à-vis de la toxicité potentielle de relargables des matériaux constitutifs ou des problématiques de stabilité physico- chimique de la formulation (agrégation, adsorption, dégradation…) La fonctionnalité doit être assurée par une mise sous contrôle des dimensions critiques de l’ensemble des composants, particulièrement aux interfaces entre le packaging primaire du médicament et le dispositif d’administration. Dans le cas d’une administration parentérale, la maitrise de la robustesse des procédés de siliconisation, de remplissage et d’assemblage mécanique, voire électromécanique s’impose pour assurer l’ensemble des fonctionnalités du produit combiné.
Le choix des composants, les spécifications et la stratégie de contrôle produits / procédés doivent être établis en évaluant notamment les risques associés à une mauvaise maitrise des forces, des temps d’injection et de la précision de la dose délivrée, particulièrement pour les formulations à viscosité importante.
Autre aspect majeur de la mise sur le marché des produits combinés, la maitrise de l’aptitude à l’utilisation et des facteurs humains est essentielle non seulement pour assurer la sécurité d’utilisation du produit mais également pour créer une préférence d’utilisation chez le patient, favoriser son adhésion au traitement et son efficacité.
Les études de facteurs humains permettent d’anticiper, de comprendre, d’optimiser et de mettre sous contrôle la façon dont les utilisateurs vont interagir avec le produit, afin d’éviter les erreurs d’utilisation et de limiter les risques liés à une mauvaise manipulation.
L’analyse des risques d’erreur d’utilisation dès les premiers stades de conception, puis la conduite d’études, permettent d’engranger des données supportives sur la sécurité d’utilisation du produit et les bénéfices apportés, et in fine de valider les choix de conception réalisés.
Conclusion & perspectives
Les innovations thérapeutiques et technologiques sont des vecteurs majeurs du développement des produits combinés injectables.
La complexité de ces produits et le renforcement du cadre règlementaire nécessitent des évolutions organisationnelles et culturelles significatives chez les industriels ainsi qu’une approche intégrée du cycle de vie de ces produits et l’apport d’expertises pluridisciplinaires pointues, supportées par des méthodologies robustes de développement et de gestion des risques.
Les textes et guidelines sur les produits combinés sont relativement récents et dynamiques, ce qui offre des perspectives d’harmonisation globale dans les prochaines années. Les industriels attendent également plus de clarté et de précision sur les données attendues dans les dossiers règlementaires et leur présentation.
Le développement des nouvelles technologies et de la connectivité des dispositifs amène également de nouveaux enjeux autour de la gestion des données et soulève des questions de protection des informations patients, de maitrise de l’intégrité des données et de la cybersécurité des systèmes.
Les industriels devront intégrer ces aspects et les évolutions règlementaires associées dans leurs processus de gestion de risques avant de permettre aux patients et à l’ensemble des acteurs de santé de bénéficier de ces innovations majeures.
Partager l’article

Guillaume BONNEFOND – Aktehom
Ingénieur de formation et titulaire d’un master en management, Guillaume évolue depuis près de 20 ans dans l’industrie du médicament et des dispositifs médicaux. Son parcours, initialement orienté sur le pilotage de projets R&D et d’industrialisation, l’a conduit à des postes de direction et de management dans l’industrie pharmaceutique, notamment chez AGUETTANT et SANOFI et aujourd’hui chez AKTEHOM.
guillaume.bonnefond@aktehom.com

Loïc MENNRATH – Aktehom
Docteur en Pharmacie, Loïc s’est spécialisé dans le domaine des dispositifs médicaux avec un master technico- réglementaire à l’université Claude Bernard (Lyon). Fort d’une expérience en tant que chargé d’affaires réglementaire dans une entreprise commercialisant médicaments et dispositifs médicaux, il est aujourd’hui consultant AKTEHOM.
loic.mennrath@aktehom.com
Glossaire
CDER : Center of Drug Evaluation and ResearchCDRH : Center for Devices and Radiological Health
cGMP : current Good Manufacturing Practice
DM : Dispositif Medical
EMA : European Medicines Agency OCP : Office of Combination Products PMOA : Primary Mode of Action UDI : Unique Device Identifier
Références
- Directive 2001/83/CE du parlement européen et du conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments à usage humain
- Règlement 2017/745 du parlement européen et conseil du 5 avril 2017, relatif aux dispositifs médicaux. 2017.
- Quality requirements for drug-device combinations, (draft for consultation). European Medicines Agency; 2019.
- Code of Federal Regulations Title 21, Parts 3, 4, 210, 211 & 820. Food and drug administration (FDA); 2019.
- ICH Q8 (R2) Pharmaceutical development. ICH; 2014.
- ICH Q9 Quality risk management. ICH; 2005.
- ICH Q10 pharmaceutical quality system. ICH; 2008.
- ICH Q11 Development and manufacture of drug substances. ICH; 2011.
- ICH Q12 Technical and regulatory considerations for pharmaceutical product lifecyclemanagement. ICH; 2017.
- NF EN ISO 13485 :2016 – Dispositifs médicaux —Systèmes de management de la qualité —Exigences à des fins réglementaires. AFNOR; 2016.
- NF EN ISO 14971 : Application de la gestion des risques aux dispositifs médicaux. AFNOR; 2019.
- ISO 10993-1:2018 – Évaluation biologique des dispositifs médicaux — Partie 1: Évaluation etessais au sein d’un processus de gestion du risque. AFNOR; 2018.
- Technical Considerations for Pen, Jet, and Related Injectors Intended for Use with Drugs andBiological Products. Food and drug administration (FDA); 2013.
- ISO 11608 (Parts 1-7) Systèmes d’injection à aiguille pour usage médical — Exigences etméthodes d’essai. ISO;
- ISO 11040-8:2016 – Prefilled syringes — Part 8: Requirements and test methods for finishedprefilled syringes. ISO;
- ISO 7886 (Parts 1-4) : Seringues hypodermiques stériles, non réutilisables. ISO;
- NF EN ISO 62366-1 : 2015 : application de l’ingénierie de l’aptitude à l’utilisation aux dispositifsmédicaux. AFNOR; 2015.
- Applying Human Factors and Usability Engineering to Medical Devices. Food and drug administration (FDA); 2016.