Sommaire
- La restriction des PFAS dans l’industrie : enjeux réglementaires et impacts sur l’industrie pharmaceutique
- La technologie Blow-Fill-Seal dans l’industrie pharmaceutique : performance, applications et durabilité
- Key Allies in Preventing Contaminants and Impurities in Bioproduction
- Choosing the right vial: packaging sterile drug products with foresight
- Combination Products in the United States and European Union: Differences and proposed strategy to prepare common CTD Quality Module 3
- Blood plasma processing. When every drop counts
- L’analyse de la normalité en Continued Process Verification
- Qualification of impurities
- Pharma 2052
La restriction des PFAS dans l’industrie : enjeux réglementaires et impacts sur l’industrie pharmaceutique
L’Agence Européenne des Produits Chimiques (ECHA) propose de restreindre l’utilisation des substances peret polyfluoroalkylées à usage industriel à partir de 2027. Les restrictions proposées et les commentaires du public reçus lors de la période de consultation publique de 2023 sont actuellement examinés par l’ECHA secteur par secteur, afin de déterminer si des exceptions ou des reports de mise en œuvre pour des utilisations spécifiques seront recommandés. Par ailleurs, une évaluation socio-économique avec consultation publique, probablement fin 2025, constitue également un élément essentiel du processus de l’ECHA
Récemment, les parutions et études se sont multipliées sur le sujet de la contamination par les PFAS dans les effluents et dans l’eau et l’impact sur l’environne- ment et la santé. Les autorités qui se sont emparées du sujet et notamment l’ECHA (Agence Européenne des Produits Chimiques) ont proposées une série de mesures visant à réduire drastiquement l’usage des PFAS.
Il existe encore cependant beaucoup de zone d’ombre sur le type de PFAS concernés, la détection et les niveaux acceptables dans les produits pharmaceutiques, ainsi que les moyens de substitution.
L’objet de cet article est de faire un état des lieux et d’analyser les impacts potentiels sur l’industrie pharmaceutique.
1. Que sont les PFAS ?
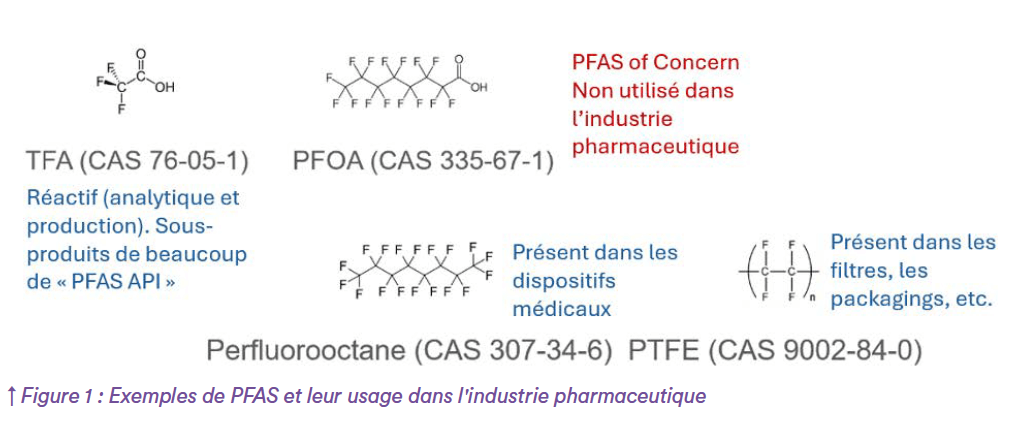
Les substances les plus connues et les plus étudiées de la famille des PFAS sont le PFOA (acide perfluorooctanoïque) et le PFOS (sulfonate de perfluorooctane), qui sont déjà interdites. Le champ d’application actuel de la proposition REACH élargit considérablement le champ des substances couvertes par la définition des PFAS de l’ECHA, incluant des dizaines de milliers de substances potentielles, dont beaucoup sont couramment utilisées dans un large éventail d’applications.
2. Leurs propriétés physico-chimiques particulières
3. Risques environnementaux et sanitaires associés à leur usage
Les données scientifiques portant sur les PFAS et leurs effets potentiels sur la santé humaine sont abondantes et s’enrichissent continuellement. Le degré de certitude attribué aux divers effets est variable. Parmi les effets connus pour l’être humain, on compte l’augmentation du taux de cholestérol, des cancers, des effets sur la fertilité et le développement du fœtus, sur le foie, sur les reins, etc. Les PFAS sont également suspectés d’interférer avec le système endocrinien (thyroïde) et immunitaire. Des effets peuvent survenir sur les autres organismes vivants.
4. Réglementation actuellement applicable en Union Européenne
Depuis 2014, un groupe de coordination informel composé de plusieurs pays de l’UE, de l’ECHA et de la Commission européenne a examiné les données sur les PFAS contenues dans la base de données d’enregistrement de l’ECHA et coordonné les travaux réglementaires en groupe.
Malgré une approche efficace par rapport à la réglementation substance par substance, les travaux n’ont pu couvrir que les groupes de PFAS les plus urgents en raison du très grand nombre de PFAS. Le règlement POP (polluants organiques persistants), issu de la convention de Stockholm, interdit :
– Depuis 2009, l’acide perfluorooctane sulfonique et ses dérivés (PFOS).
– Depuis juillet 2020, l’acide perfluo- rooctanoïque (PFOA), ses sels et ses dérivés.
– Depuis juin 2022, l’acide Perfluorohexane sulfonique (PFHxS), ses sels et ses dérivés.
L’inclusion des acides perfluorés carboxyliques à longue chaîne (C9-21 PFCAs) est envisagée pour être incluse dans la Convention de Stockholm et en prévoir l’élimination à l’échelle mondiale.
Ces interdictions ou restrictions imposées par le règlement POP peuvent porter sur les substances en tant que telles, ou lorsqu’elles sont sous forme de constituants d’articles, ou incorporées dans des préparations au-dessus de certains seuils.
Le règlement européen REACH restreint déjà :
– Depuis février 2023, l’acide perfluoro carboxylique (C9-14 PFCAs), ses sels et ses dérivés.
– A partir d’avril 2026, l’acide undecafluoro hexanoique (PFHxA), ses sels et ses dérivés.
La base de données de l’ECHA contient des informations sur plusieurs milliers de PFAS individuels sur le marché de l’UE. Ceux-ci appartiennent à une variété de sous-groupes. L’évaluation et, le cas échéant, la gestion des risques sous- groupe par sous-groupe nécessiteraient beaucoup de temps, une approche groupée en matière d’évaluation réglementaire et de gestion des risques parait nécessaire.Evolution de la réglementation 2023-2024
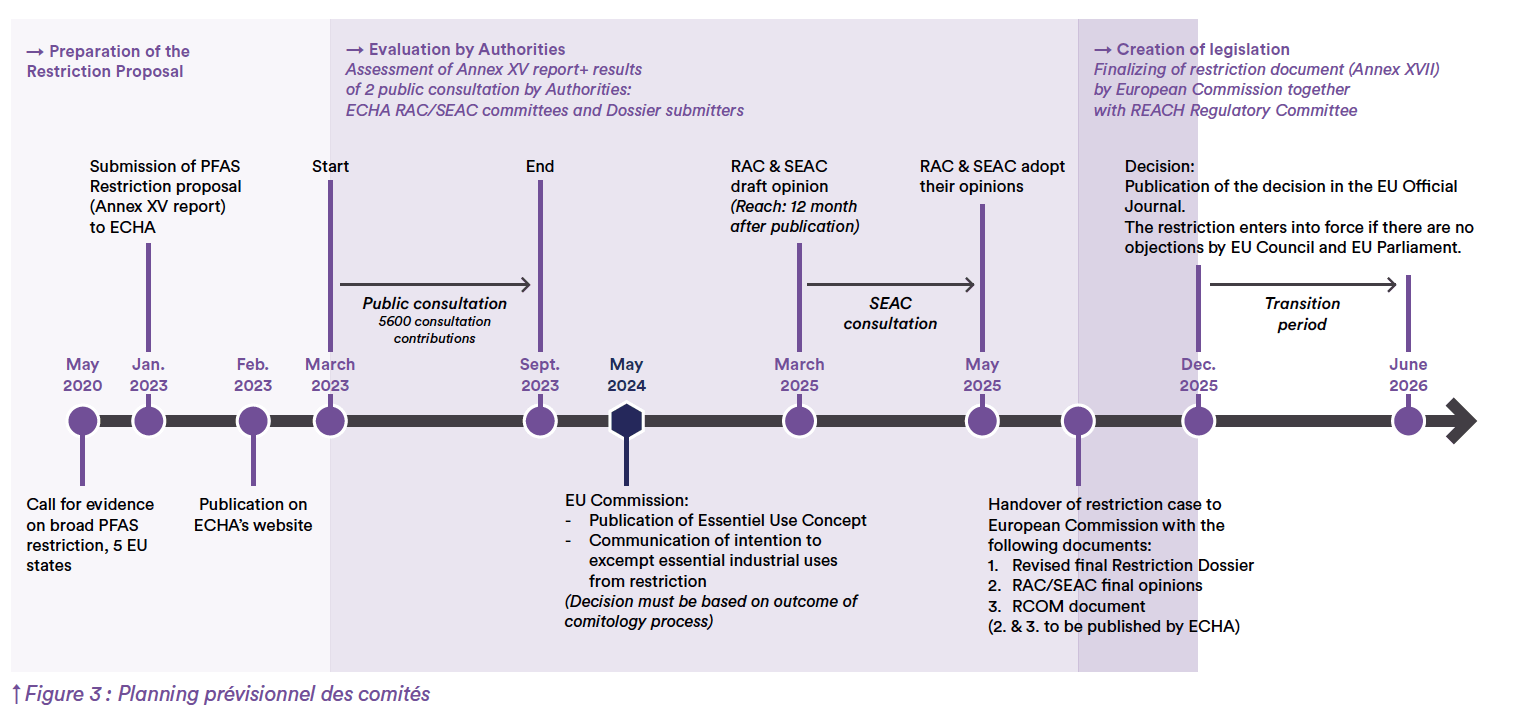
En mars 2023, sous l’impulsion des autorités nationales de l’Allemagne, du Danemark, des Pays-Bas, de la Norvège et de la Suède, l’ECHA a publié un projet de proposition, dans le cadre du rapport de restriction de l’annexe XV, pour la restriction des PFAS. Elle propose l’interdiction en Europe de la fabrication et la mise sur le marché de substances, mélanges et articles contenant des PFAS sur la base de leur caractère persistant. La proposition de restriction porte sur environ 10 000 substances (PFAS et leurs dérivés) dans le but de prévenir l’accumulation de PFAS dans l’environnement, la chaîne alimentaire et les effets sur la santé humaine. Il a un impact significatif sur diverses industries, y compris le secteur pharmaceutique. Une fois définitive, la restriction sera appliquée en vertu du règlement REACH dès 2027. Une restriction dans le cadre de REACH a été considérée comme l’outil le plus efficace pour gérer le risque lié aux PFAS utilisés dans les processus et les produits industriels.
Deux comités ECHA ont été créés pour piloter le projet : le Comité d’évaluation des risques (CER ou RAC) et le Comité d’analyse socio-économique (CASE ou SEAC).
Par la suite, les comités RAC et SEAC élaboreront un avis sur la base des informations contenues dans la proposition de restriction et des commentaires soumis par les parties prenantes. Les États membres de l’UE peuvent également fournir des conseils aux comités. La Commission européenne analysera les risques, les avantages et les coûts associés aux avis du RAC et du SEAC, et la décision finale sera prise par les États membres et le Parlement.
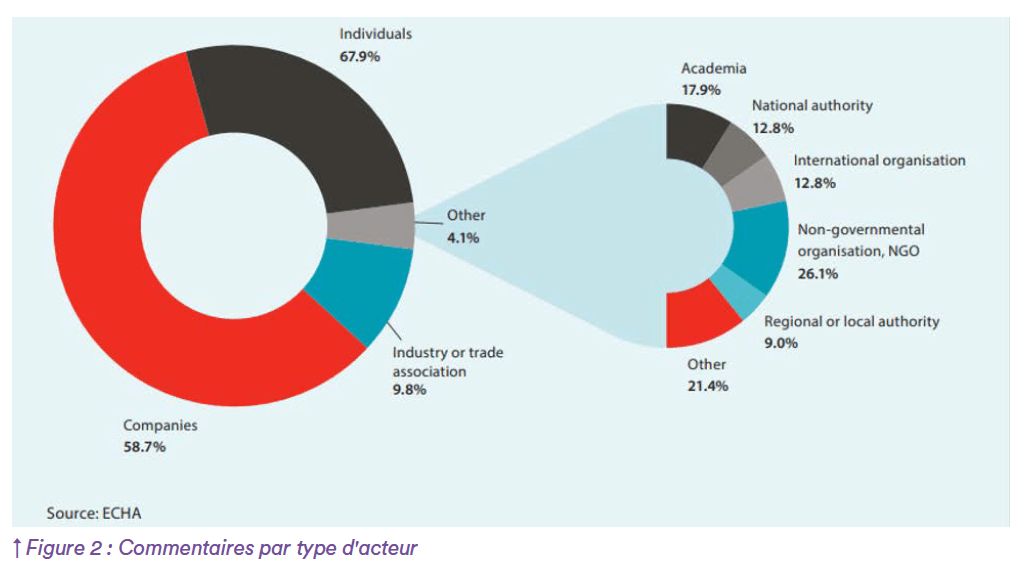
Le délai de traitement a été prolongé au vu du grand nombre de commentaires reçus de la part de multiples acteurs à la suite de la consultation ouverte par l’ECHA (cf Figures 1 et 2). De nombreux commentaires, tels que ceux du Conseil des ministres de l’économie allemand à la fin de 2024, ont indiqué qu’une interdiction totale est improbable et qu’il y aura au moins quelques exemptions pour l’industrie. On estime qu’il faudra 4 à 5 ans à compter de la soumission (février 2023) jusqu’à la décision finale de la Commission européenne.
L’annexe XV ne mentionne que deux options de restriction :
- Une interdiction totale sans dérogation et une période de transition de 18 mois.
- Une interdiction complète assortie d’une dérogation limitée dans le temps pour une utilisation spécifique qui implique une période de transition de 18 mois et une période de dérogation de cinq ou 12 ans.
La demande de dérogation exigera de disposer d’éléments de preuve suffisamment solides pour justifier sa nécessité.
En ce qui concerne les dérogations illimitées, l’intention est de couvrir des cas particuliers pour des raisons pratiques. L’utilisation des PFAS comme substances actives dans les produits phytopharmaceutiques, les produits biocides et les médicaments est l’un des rares exemples puisque ceux-ci sont couverts par des réglementations spécifiques.
Bien que des dérogations limitées dans le temps soient mentionnées à l’annexe XV, le secteur pharmaceutique n’a fait l’objet que d’une attention limitée dans le projet, le focus s’étant porté sur l’alimentation et les biens de grande consommation.
Cependant, comme l’a publié la Fédé- ration européenne des associations et industries pharmaceutiques (EFPIA), les conséquences de la mise en œuvre de la proposition de restriction risqueraient d’entraîner des ruptures d’approvisionnement et, en fin de compte, d’affecter négativement la fourniture de médicaments aux patients sur le territoire européen.
5. Impacts potentiels pour l’industrie pharmaceutique
2. Développement de produits et d’API, y compris les programmes mondiaux, c’est-à-dire les produits réglementés non européens;
3. Ingrédients non actifs (excipients);
4. Matières premières et intermé- diaires chimiques;
5. Équipement et consommables;
6. Réactifs, solvants, catalyseurs, auxiliaires dans la production et le contrôle de la qualité;
7. Matériaux d’emballage immédiat et barrières stériles;
8. Dispositifs médicaux.
6. PFAS et systèmes à usage unique
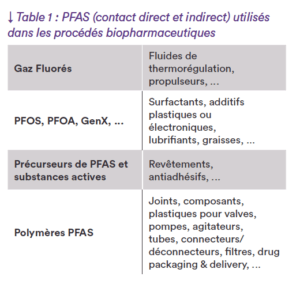
Les bioréacteurs, les poches et les filtres stérilisants liquides utilisés sont généra- lement exempts de PFAS (à l’exception notoire des membranes PVDF), mais de nombreux composants à leur périphérie contiennent des polymères PFAS. Les polymères PFAS se trouvent dans les colliers, les tuyaux, les raccords, les connecteurs stériles, les filtres à air, les vannes, les pompes, les agitateurs, les composants électroniques et dans certains matériaux d’emballage. Les filtres à air, ainsi que les connecteurs et déconnecteurs stériles, contiennent intentionnellement des PFAS (le plus souvent des membranes PTFE).
Les polymères PFAS sont essentiels au fonctionnement de ces produits et dans leur processus de fabrication (cf Table 1). Dans certains cas, aucune alternative n’existe à date.
– Les chaînes d’approvisionnement et leur importance sont complètement négligées dans le dossier initial des restrictions.
– Il subsiste un certain manque de transparence dans le travail d’évaluation des autorités. Les associations d’intervenants accréditées peuvent assister aux réunions des comités d’évaluation. L’ECHA publie les procès-verbaux de ces réunions, les rapports d’avancement et le calendrier des travaux. Tous les autres documents (révision du dossier et projet d’avis du CER et du CASE) sont confidentiels. Les soumissionnaires du dossier ont annoncé qu’ils avaient l’intention “d’identifier les utilisations des PFAS, qui n’ont pas été évaluées dans le rapport initial (“utilisations manquantes”), d’intégrer ces utilisations dans les évaluations sectorielles existantes ou de créer des secteurs supplémentaires, si nécessaire”. Les autorités s’engagent à fournir toutes les mises à jour dans les plus brefs délais tout en assurant la cohérence et la qualité de leurs évaluations.
- Les autorités ont évalué environ 25 % des cas d’utilisation énumérés dans le dossier de restriction.
- Les autorités ont identifié les nouveaux cas d’utilisation des PFAS (non répertoriés dans le dossier), tels que les applications d’étanchéité, les textiles techniques, les applications d’impression et d’autres applications médicales.
- Les autorités sont parvenues à la conclusion que les impacts socio-économiques d’une interdiction des PFAS sont susceptibles d’être disproportionnés.
- Les autorités envisagent d’autres options de restriction “alternatives” (en plus du dossier), par exemple pour les polymères fluorés et l’utilisation industrielle.
Conclusion
En conclusion, la restriction des PFAS dans l’industrie présente de nombreux enjeux et défis, notamment pour le secteur pharmaceutique. Les propriétés uniques de ces substances, leur impact environnemental et sanitaire, ainsi que les évolutions réglementaires en cours nécessitent une attention particulière et une adaptation rapide des industries concernées. La mise en œuvre de solutions alternatives et de stratégies de substitution est essentielle pour répondre aux exigences environnementales et réglementaires tout en minimisant les perturbations économiques.
De nombreux produits nécessaires à l’industrie contiennent des PFAS. Les PFAS sont essentiels à presque tous les processus de fabrication et seront diffi- cilement substituables. Par conséquent, l’essentiel des lignes de production seraient impactées. La production de produits pharmaceutiques sans PFAS sera également confrontée à des défis importants une fois la restriction mise en œuvre.
Certains PFAS sont considérés comme présentant des risques faibles à négligeables, tandis que d’autres sont jugés dangereux et ont été interdits. L’utilisation de PFAS présentant des risques faibles ou négligeables est nécessaire pour la fabrication sûre et rentable de nombreuses thérapies importantes.
The PFAS reach restriction potential timeline
“Face à cette famille de substances très large et particulièrement persistante dans l’environnement, la difficulté est d’identi- fier ou de distinguer celles qui présentent des caractéristiques de danger les plus préoccupantes. Cela appelle à accélérer les recherches sur les substances, en particulier pour celles qui sont les plus fréquemment retrouvées dans l’environ- nement, et à développer des approches innovantes pour caractériser leur toxicité.”
Matthieu Schuler (Directeur général délégué du pôle Sciences pour l’expertise de l’Anses)
Partager l’article
GIC Single-Use



