Juin 2013
La Vague n°38
Particulièrement PARTICULES
Sommaire
- Risques particules et verre dans les produits injectables.
- De la prévention à la détection des particules visibles.
- La maitrise de la contamination particulaire dans la production de bouchons en élastomère.
- Confluences particulaires, de la visibilité partagée.
- L’analyse de risque partagée entre fournisseurs et utilisateurs : une garantie de sécurité pour les patients.
- Revue des Pratiques d’Inspection Visuelle.
L’analyse de risque partagée entre fournisseurs et utilisateurs : une garantie de sécurité pour les patients
1. Contexte et méthodes de travail du sous-groupe 1 :
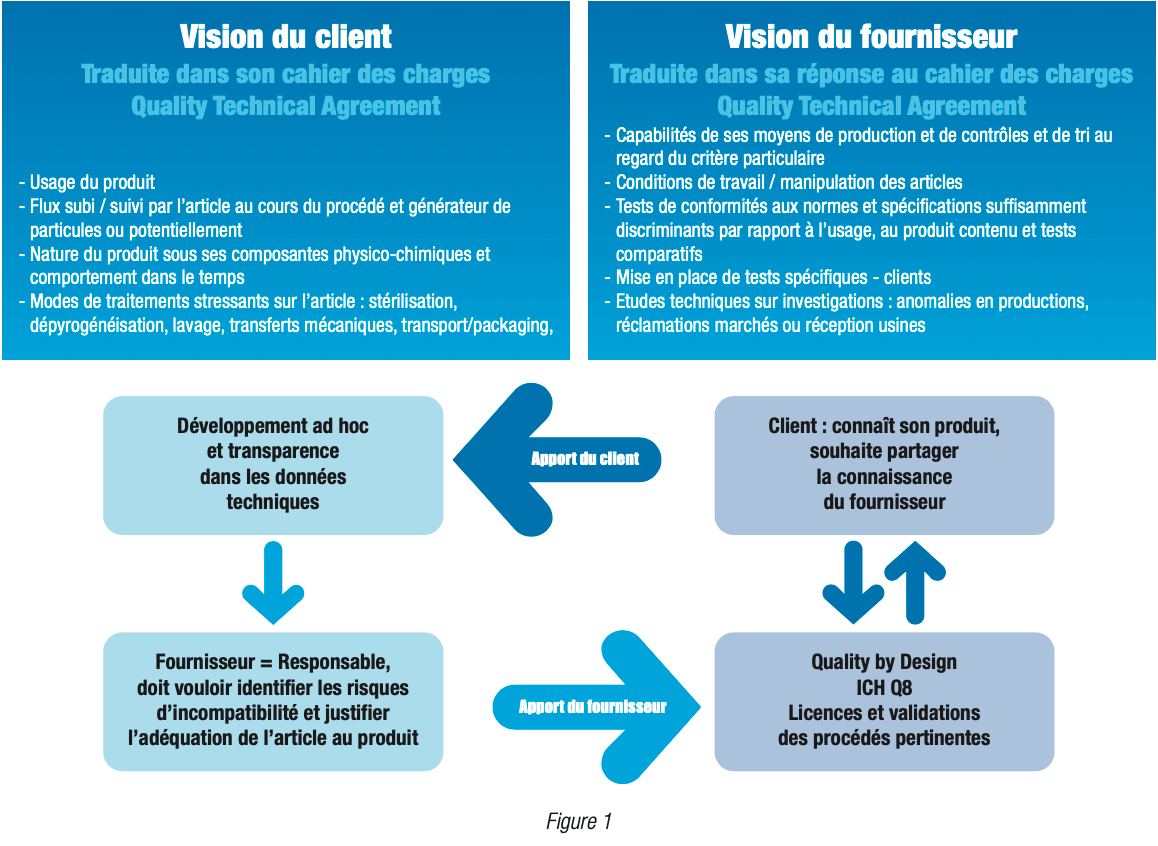
Les fournisseurs présents sont au nombre de 4 pour les articles en verre et représentent la majorité de nos achats industriels sur les sites et ont délégué 8 experts. Ceux représentant les articles en élastomères, les composants en feuilles et producteurs de sacs / sachets y compris constitués de DPTE®1 sont au nombre de 5, déléguant 7 experts ; la représentativité de ce panel de fournisseurs est exceptionnelle et nous nous félicitons de pouvoir travailler de façon aussi ouverte entre industriels du médicament stérile et injectable avec des fournisseurs concurrents et responsables qui ont accepté le challenge suivant décrit dans notre “carré magique” et décliné selon des méthodes d’analyses de risques éprouvées (voir nos figures et tableaux dans cet article).
Comment boucler entre les besoins des industriels – utilisateurs et les professionnels des articles primaires en contact direct avec nos produits ? Nous avions convenu d’un carré gagnant en respectant les attendus et exigences réglementaires de la Commission Tripartite ICH2 Q83– Q94 et Q105 que nous pouvons résumer ainsi.
Les méthodes utilisées ont été, chronologiquement :
- Le partage du descriptif des procédés de fabrication et de leurs variantes entre fournisseurs, sans contraindre aucun de décrire des spécificités confidentielles à traiter ensuite avec chaque donneur d’ordre,
- La mise en page d’analyses :
a. Une méthode condensée de l’analyse des risques et centrée sur l’utilisateur final pour les verriers : PHA pour Preliminary Hazard Analysis
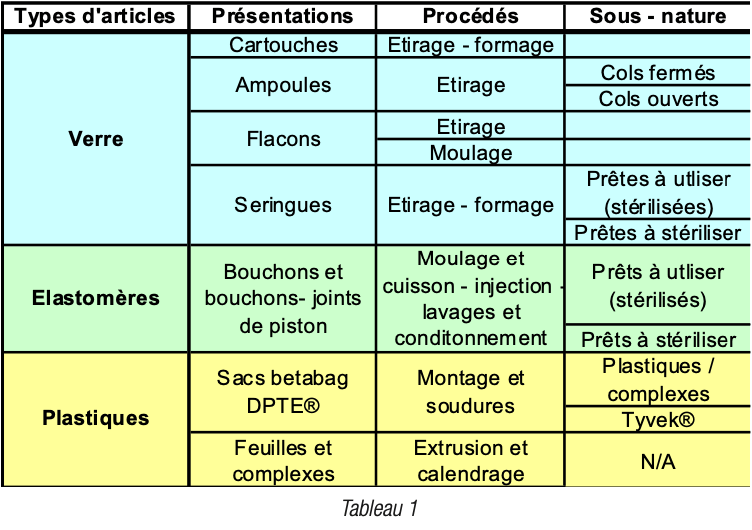
b. Une méthode plus détaillée de l’analyse des modes de défaillance pour les articles en élastomères et plastiques : AMDEC pour Analyse des Modes de Défaillance et Effets de leur Criticité (FMEA&C en anglais) - Chaque type de procédé en étapes et sous – étapes a été décrit et les différents types de procédés ont été évalués comme par exemple et de façon non exhaustive, précisé dans le tableau 1.
- Il en ressort et en ressortira dans les sessions de travail programmées en 2013, des point critiques de maîtrise des procédés reconnus par tous et traités comme moyen de PREVENTION auquel associer les moyens de DETECTION adéquats,
- Les modes de contrôles pour les articles notamment en élastomères au regard des normes applicables notamment NF EN ISO 8871-3, IEST 1246D, les déclinaisons de la série 14644… Pour le verre, on fait appel pour la description des défauts aux standards internationaux déjà établis que sont le “PDA Tubular Glass Lexikon (TR-43-2007)” et “Defect Evaluation List for Containers Made of Tubular Glass (4th Edition 2009 – Cantor Verlag)”.
2. Résultats intermédiaires et perspectives
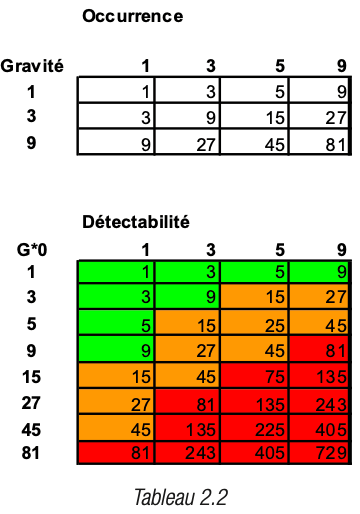
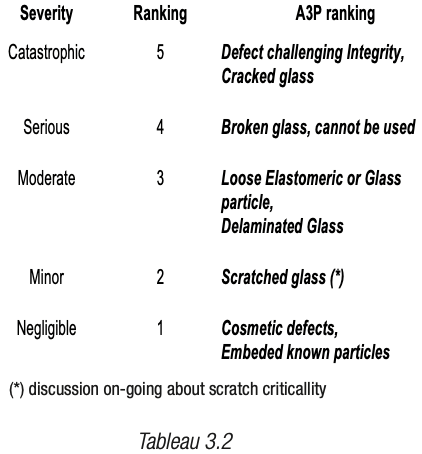
Les deux sous-groupes ont établi chacun une grille de cotation du risque, préambule indispensable à toute évaluation qui donnera lieu à une priorisation des risques. Pour le sous-groupe élastomères et plastiques, la grille retenue est décrite dans les tableaux 2 (2.1 et 2.2) et pour le sous-groupe des verriers, celle-ci est définie dans les différentes déclinaisons des tableaux 3 (3.1 à 3.3).
Les critères qui ont prévalu tiennent compte d’un impact direct sur la qualité6, l’innocuité, la toxicité et la pureté des produits en contact.
Note des auteurs : les intitulés des tableaux peuvent être rédigés en anglais du fait de travaux en langue anglaise avec un panel d’experts internationaux qui ont exprimé les besoins et conclusions en anglais tout au long de sessions de travail (verriers).
Définition des critères de sévérité, d’occurrence et de détectabilité dans le traitement des risques associés aux procédés de fabrication des élastomères et dispositifs en plastiques.
Résultats de cotation par croisement des données de risques et évaluation des zones prioritaires de risques par le chiffrage
Remarque : les matrices peuvent être de même nature pour des procédés dont l’objectif est le même : dans ces cas (tableaux 2.2 et 2.3), vous pouvez corréler les choix entre les experts du sous-groupe SG1 à ceux des participants au SG2 où les procédés de formulation- répartition et bouchage ont un objectif commun : délivrer au client final (Voix du client / VOC) le produit sans particule visible. Le client final est successivement l’atelier de fabrication pour les contenants primaires, voire les ateliers en amont (préparation du matériel par lavage, stérilisation, décontamination avec transferts, manipulations et emballages compris) puis l’inspection visuelle ou électronique pour les procédés en aval.
Rejoignez les espaces forum et les présentations disponibles sur le site internet A3P (www.a3p.org) et vous référer à nos précédentes publications et posters en 2012.
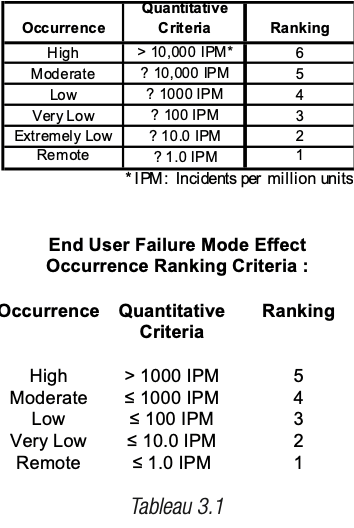
Niveau de criticité pour l’utilisateur final basé sur la probabilité d’occurrence d’un défaut dans le produit fini (tient compte de l’occurrence initiale et des moyens de détection/élimination disponibles).
Concernant les IPM, pour un verrier qui dispose de procédés continus et plus généralement dès que des données historiques sont disponibles en nombre suffisant, la notion de IPM est une notion plus facile à manier et plus universelle que l’usage d’une occurrence par lot, la taille de lot étant variable d’un produit et d’un fabricant à un autre.
Concernant la gravité :
La gravité est une notion indépendante de l’occurrence. Ici pour le verre l’occurrence retenue est d’ailleurs le résultat final de l’occurrence initiale pondérée de sa détectabilité (en d’autres termes, un défaut facilement détecté et donc éliminé tout au long de la chaine de fabrication aura une occurrence plus faible au niveau du patient qu’un défaut mal détecté et éliminé de même occurrence initiale).
End User Failure Mode Effect Severity Ranking Criteria
Nous pouvons constater la puissance des méthodes rigoureuses des évaluations finales des risques quand des outils comparables sont utilisés par tous lors de sessions où les participants sont conscients qu’il ne peut être retenu de partenariat dans l’analyse du risque sans culture commune.
Nous recommandons donc à chaque partenaire de poser sur la table les procédés de fabrication et de contrôle7, les modes de défaillance et de les conjuguer aux exigences et besoins des clients finaux vis-à-vis de leurs patients et de leurs marchés, Autorités comprises.
La valeur intrinsèque du chiffre a peu d’importance, mais une échelle de valeurs doit être mise en évidence et argumentée afin de discriminer au mieux les risques finaux pour mieux les réduire, en accepter l’occurrence résiduelle et agir sur des modes de prévention ou de détection plus robustes.
Ces sessions de travail ont été closes en priorisant les risques par des choix communs de procédés, d’étapes et de critères d’acceptation sur lesquels nous avons une certitude d’un besoin d’amélioration et ainsi donner à tous des pistes de réflexion. Ces données seront partagées au prochain Forum du 4 juillet 2013 au Vaudreuil (Val de Reuil) et seront mises en lignes sur www.a3p.org.
Conclusions
Pour les contenants primaires nous sommes près du but fixé : partager nos connaissances des procédés au regard des besoins des utilisateurs finaux et des données constatées sur nos livraisons, nos réclamations – fournisseurs, nos réclamations des marchés et les niveaux de robustesse atteints ainsi par nos procédés cumulés.
Nous utilisons ces données dans trois domaines essentiels pour la garantie de qualité particulaire visible des produits stériles et injectables :
- Les points critiques de maîtrise des procédés (CCP8 et CQA9, CPP10 sont connus et nos fournisseurs peuvent agir en connaissance de cause,
- Les contrôles en cours de procédés (IPC11) peuvent être ajustés et leurs critères d’acceptation clairs autorisent la libération des lots en toute confiance pour l’utilisation chez le producteur pharmaceutique,
- Les moyens de détection, reconnus comme insuffisamment robustes (tels les NQA12 en entrée, les traitements avant remplissage, les inspections visuelles dont les limites sont connues, les tests normalisés ou déposés non discriminants..) deviennent l’un des moyens d’assurer la propreté particulaire mais pas le seul ; les contrats qualité et techniques, les cahiers des charges s’enrichissent et sont plus facilement approuvés par les fournisseurs et leurs donneurs d’ordre.
Une véritable traçabilité de la supply chain des articles est renforcée et répond aux nouvelles exigences des BPF de l’Union Européenne (chapitre 5 production & chapitre 7 activités sous- traitées).
La charte que nous prévoyons d’écrire est principalement constituée des arguments défendus par les partenaires au sein du sous-groupe SG1 puis de nos engagements induits travaillés au SG2 :
- Transparence dans l’approche et l’évaluation des risques,
- Adaptation nécessaire à chaque client par le procédé ou la spécification-article,
- Protection absolue du savoir –faire de chacun au travers des accords de confidentialité,
- Balance de prévention versus la détection qui doit être en faveur de la prévention et qui doit être supportée par des échanges fréquents sur les contraintes respectives de chaque entreprise
- Machinabilité
- Spécificité des exigences des Autorités,
- Composition du produit à répartir,
- Essais préalables suffisants,
- Présentation de la supply chain globale de l’article depuis sa production jusqu’à son utilisation sur ligne de répartition pharmaceutique (ceci inclus les transferts, manipulations, stockages, changement de température et d’hygrométrie, déconditionnement, prélèvements…),
- Contraintes d’utilisation vis-à-vis du patient des contenants primaires dans les systèmes d’injection,
- Partage des données (feedback) des marchés en réclamations, rappels (cf. SG4),
- Modification et amélioration de nos systèmes de détection (cf. pratiques traitées au SG3).
Détection fiable par des tests validés, robustes, mettant en évidence les “blancs” et “lignes de base” de contamination particulaire lors des essais en laboratoires où qu’ils soient réalisés (fournisseur, laboratoire sous – traitant et client).
La discussion pourra se poursuivre sur les différentes notions de gravité selon les articles en verre ou en élastomères et plastiques non seulement sur leurs natures mais aussi sur les utilisations envisagées pour le patient final.
Nous avançons sur ce chemin de vérités décodées, redécouvertes, acceptées, cotées, transmises et traduites en agréments communs grâce aux efforts de tous et à ces groupes conviviaux que nous tenons à remercier pour leur haute contribution dans l’assurance de qualité des particules visibles.
GIC Particules Visibles
SG1 : Prévention et détection des sources de particules dans les contenants primaires et les articles en contact avec les produits stériles. Sociétés impliquées : Aptar Stelmi, Becton Dickinson Europe, Catalent Pharma Solutions, Datwyler PH. Pack, Gerresheimer Bunde, Institut de la Filtration et Techniques Séparatives, Lilly, Merck Millipore, Merial, Sanofi Pasteur, Schott Glass, SGD, Stevanato group, Tekniplex, West.
SG2 : Evaluer, prévenir et réduire la contamination particulaire lors des procédés de mise sous forme pharmaceutique : formulation, mélange, répartition / répartition / scellage – bouchage et lyophilisation si applicable.
Sociétés impliquées : Institut de la Filtration et Techniques Séparatives, Lilly, Pierre Fabre Médicament Production, Recipharm, Rgmp Compliance, Sanofi Pasteur.
SG3 : Visual Inspection Practices.
Sociétés impliquées : GlaxoSmithKline Biologicals, GlaxoWelcome Production (GSK), Leo Pharma, Lilly, Merck Schering Plough, Merial, Octapharma, Pierre Fabre Médicament Production, Sanofi Pasteur.
SG4 : Données des marchés, évaluation et statistiques. Arbre décisionnel sur le management du risque patient.
Sociétés impliquées : Eusapharma, GlaxoSmithKline Biologicals, GlaxoWelcome Production (GSK), Novo Nordisk, Rgmp Compliance.
Partager l’article
Alain EUZEN – AXYS NETWORK
Benoît LUX – LILLY
François Fonvielle – SANOFI PASTEUR
Références
[1] : Double Porte pour Transfert Etanche (marque déposée)
[2] : International Conference of Harmonisation
[3] : Pharmaceutical Development : Quality by Design
[4] : Quality Risk Management
[5] : Quality System Management
[6] : SQIPP pour les textes anglais : Safety, Quality, Inocuity, Purity, Potency
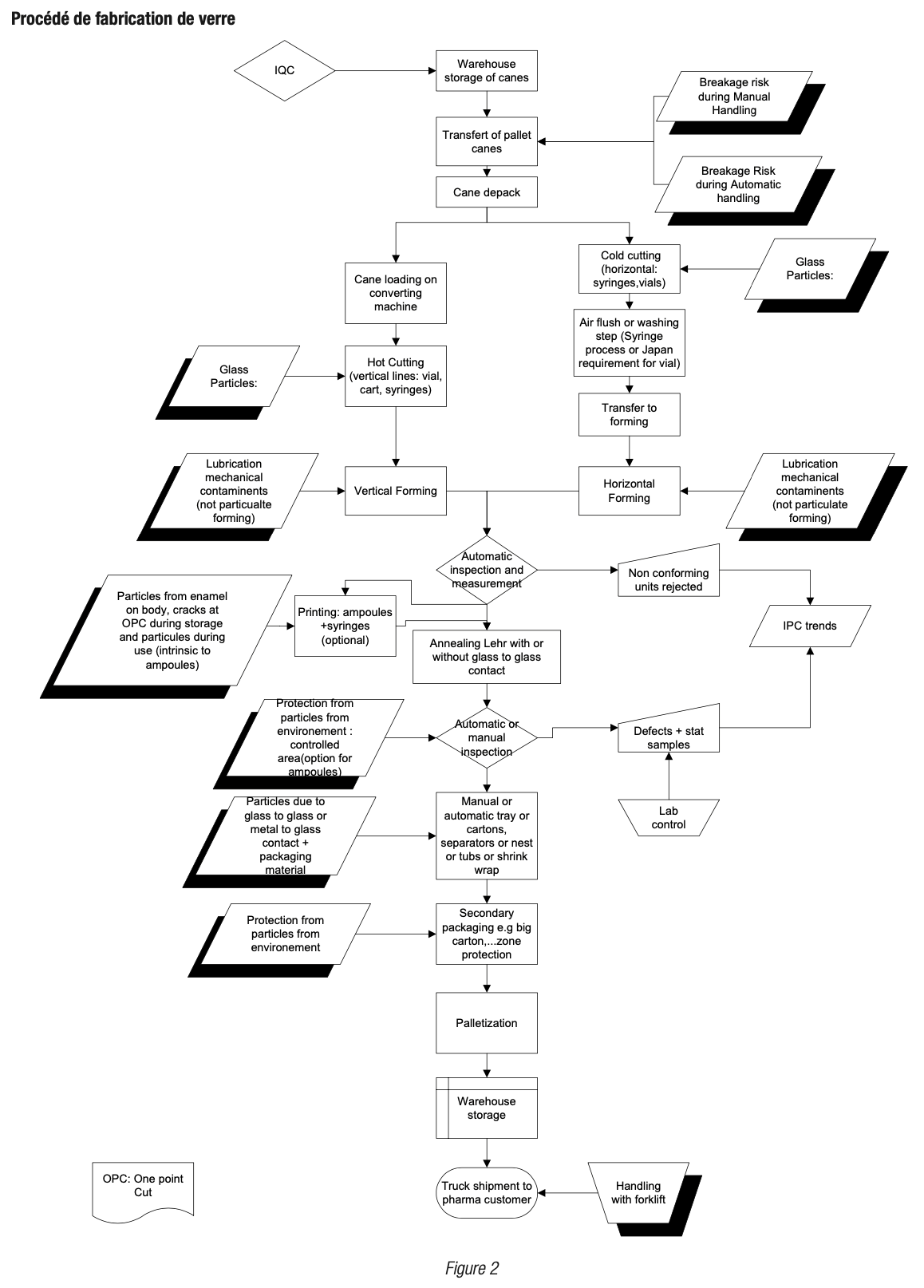
[7] : Exemple de procédé décrit pour un procédé de fabrication de verre en figure 2
[8] : CCP : Critical Control Parameters
[9] : CQA : Critical Quality Attributes
[10] : CPP : Critical Process Parameters
[11] : IPC : In-Process Controls
[12] : NQA : Niveau de Qualité Acceptable (Acceptable Quality Level AQL en anglais).