Sommaire
- Pourquoi et comment faire une caractérisation thermique d’un produit avant lyophilisation ?
- Les clés d'une qualification réussie
- Comment mener une analyse de risque contamination sur un procédé de lyophilisation ?
- CIP evolution in freeze dryers. Optimize turnaround time & water consumption
- Basiques en simulation de procédés aseptiques et lyophilisation
- Silicon oil detection in pharmaceutical freeze dryer by mass spectrometry
- Les spectromètres de masse. Retour d'expérience
- EN 17272. Nouvelle norme relative à la désinfection par voie aérienne automatisée
Comment mener une analyse de risque contamination sur un procédé de lyophilisation ?
Le draft de la directive européenne relative à la fabrication des produits stériles -EU GMP Annexe1- publiée par l’EMA en février 2020 s’est enrichie de modifications majeures depuis sa version offcielle publiée en novembre 2008. Si une nouvelle section 8. “Production & specific technologies” identifie désormais les requis spécifiques applicables lors de l’utilisation de technologie comme la lyophilisation une nouvelle section 3. est aussi dédiée au Pharmaceutical Quality System (PQS), fondant la maîtrise de la contamination sur le QRM (Quality Risk Management) [cf. ref ICH Q9 R1] et la formalisation de la stratégie de maîtrise dans la CCS.
La mise à jour de l’Annexe 1 répond à une évolution de la maîtrise de la stérilité, qui passe d’une maîtrise de la contamination des environnements de travail en classe A vers des systèmes clos et technologies barrières, déplaçant de fait les préoccupations principales de contamination microbienne et particulaire. Les sources sont multiples et doivent être considérées en relatif les unes aux autres, d’où l’importance du caractère méthodique, systématique et structuré du QRM pour guider l’analyse et fixer les actions de prévention (voire de détection / remédiation).
Si les principes du QRM doivent donc être appliqués (Cf. section 1 Scope “QRM applies to this document in its entirety”), comment l’utiliser pour déterminer et maîtriser les principaux risques de contamination dans un procédé de lyophilisation ?.
1. Rappel des attendus QRM selon l’Annexe 1
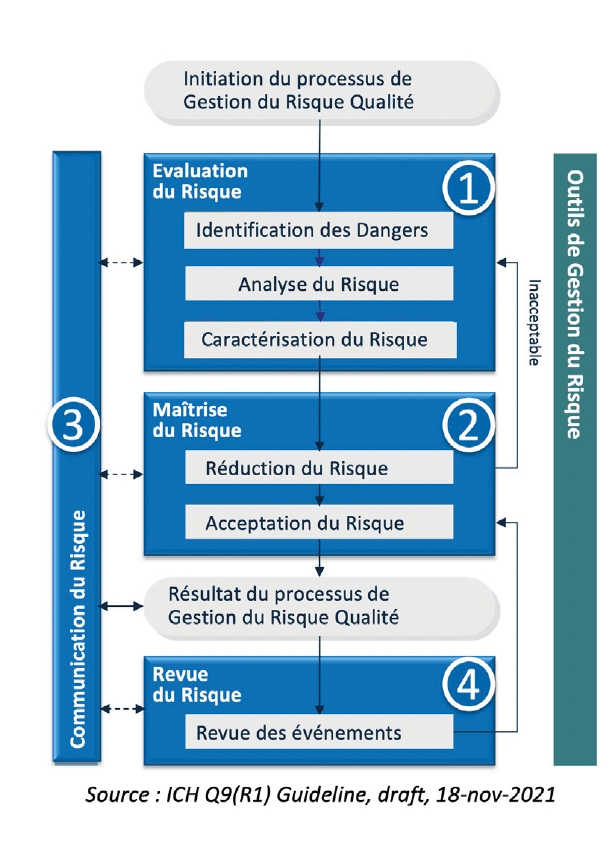
Afin de minimiser la contamination microbienne et d’assurer la qualité des produits stériles fabriqués, il sera nécessaire d’avoir un système de gestion des risques sur l’ensemble du cycle de vie du produit. L’approche doit appliquer les 4 étapes du processus de gestion de risques définies dans ICH Q9. (voir illustration)
La pertinence de la gestion des risques reposant sur la science et l’expérience, chaque fabricant devra disposer d’une connaissance et d’une expertise suffisantes en lien avec les produits fabriqués, les équipements, l’ingénierie et les méthodes de fabrication employés qui ont un impact sur la qualité du produit. L’annexe 1 s’inscrit elle-même dans ce principe, et précise que les limites ou fréquences spécifiques indiquées doivent être considérées comme une exigence minimale. Elles sont indiquées en raison de l’expérience historique de la réglementation concernant des problèmes qui ont été identifiés précédemment et qui ont eu un impact sur la sécurité des patients. L’approche doit être systématique et se fonder sur la compréhension, entre autres des interactions entre produit, procédé et équipement : nous sommes bien au cœur d’une démarche de type Quality by Design.
2. Quels types de contamination possibles dans un procédé de lyophilisation ?
Pour illustrer la mise en œuvre du QRM, nous allons nous appuyer sur l’étude d’un cas fréquemment rencontré : la lyophilisation en batch avec chargement de flacons partiellement bouchés et déchargement de flacons bouchés dans le lyophilisateur.
Comme le souligne la norme ISO 13408- 3:2006, étant donné que la lyophilisation est souvent la dernière étape d’un processus aseptique ayant un impact direct sur la sécurité, la qualité, l’identité, l’efficacité, la pureté d’un produit, la lyophilisation est une étape essentielle du traitement aseptique.
Dans le cas de la fabrication de produits stériles injectables lyophilisés, nous cherchons à garantir la prévention de la contamination microbiologique (moisissures, bactéries, virus), particulaire, et par pyrogène dans le produit final.
Le procédé et la technologie de lyophilisation doivent être conçus pour maîtriser les différentes contaminations. En effet, les technologies disponibles actuellement imposent par conception la présence de sources de contamination chimique potentielle à l’intérieur de la chambre du lyophilisateur. On peut citer par exemple : le circuit caloporteur du système de chauffage des étagères ou encore celui du système de bouchage. Une fuite de fluide peut entraîner la génération d’aérosols selon les conditions de température et de pression durant les différentes phases de séchage au sein du lyophilisateur.
La lyophilisation ayant cette spécificité de mettre en œuvre intentionnellement plusieurs utilités (air, azote gazeux, vapeur par exemple…), celles-ci constituent autant de sources de contamination potentielle, que nous pouvons considérer comme des sources de contamination génériques aux utilités en question. Pour sécuriser l’utilisation de ces sources, il sera nécessaire de mettre en œuvre une approche de type QRM dans la conception, l’installation et l’utilisation du lyophilisateur vis-à-vis de ces utilités.
Par ailleurs, si l’on considère l’ensemble des opérations du procédé de lyophilisation, l’opération de chargement/déchargement est celle qui présente un risque important étant donné que le système n’est plus clos. Dans la continuité des opérations de remplissage, l’opération de chargement doit disposer de technologies barrières comme moyen de maîtrise efficace de la contamination. Dans la continuité des opérations de bouchage, l’opération de déchargement requiert un Grade A Air Supply, pour la protection des flacons entièrement bouchés où le bouchon n’a pas encore été serti. Remarquons que le chargement/ déchargement est une opération pharmaceutique d’ouverture/ fermeture d’une porte, qui même si elle exécutée dans des conditions environnementales de grade A, peut amener à s’interroger si le lyophilisateur peut être considéré comme un système clos, au sens de la définition proposée dans l’annexe 1 : Un système clos est un système dans lequel le produit stérile n’est pas exposé au milieu environnant. Nous constatons de manière générale, que si la maîtrise de la contamination d’un procédé de fabrication peut s’obtenir par la mise en place de systèmes fermés et/ou de technologies barrières, les spécificités du procédé de lyophilisation justifient pleinement l’application des principes du QRM comme un moyen d’identifier les sources de risques, les évaluer scientifiquement, et finalement mettre en place des moyens de maîtrise adaptés.
Au-delà du cas classique de lyophilisation batch avec chargement de flacons partiellement bouchés et déchargement de flacons bouchés, les autres situations de process (lyophilisation en continu, autre contenant, vrac…) devront faire l’objet d’une mise en application du QRM avec la même approche méthodologique mais en considérant les attributs qualité critiques (CQA) propres à chaque produit final et les spécificités de chaque procédé.
3. Quelle application du QRM sur un procédé / équipement de lyophilisation ?
Même si la démarche QbD n’est pas formellement énoncée dans l’annexe 1, la maîtrise des éléments fondamentaux de la contamination (CCS) sur laquelle repose le QbD est lui un requis évoqué à plus de 40 reprises dans le texte. On peut citer par exemple : “la fréquence de la stérilisation (qui sera fonction de la conception du lyophilisateur) devrait être justifiée et documentée dans le cadre de la CCS” ou encore “Toutes les mesures de contrôle en place pour empêcher la contamination microbienne et particulaire entre le remplissage des produits à lyophiliser et la fin du processus de lyophilisation doivent être documentées dans la CCS”.
La démarche d’établissement de cette CCS permettra de répondre aux attendus de l’annexe 1 qui fixent les priorités en matière de QRM : en premier lieu, une bonne conception de l’installation, de l’équipement et du procédé de fabrication, puis la mise en œuvre de procédures adaptées, et enfin des systèmes de surveillance qui démontrent que la conception et les procédures ont été correctement implémentées et permettent d’opérer conformément aux attentes.
Pour la mise en application du QRM, la nouvelle section 3 PQS de l’annexe 1 reprend les 4 grandes étapes du processus ICH Q9 : “La gestion des risques est appliquée au développement et au maintien de la CCS, afin d’identifier, d’évaluer [Etape 1], de réduire/supprimer (le cas échéant) et de contrôler les risques de contamination [Etape 2]. La gestion des risques doit être documentée et doit inclure la justification des décisions prises en matière de réduction des risques et d’acceptation des risques résiduels [Etape 3]. Les résultats de la gestion des risques doivent être revus régulièrement dans le cadre de l’amélioration continue de la qualité, pendant les “change control” et pendant les revues périodiques de la qualité produit [Etape 4]”.
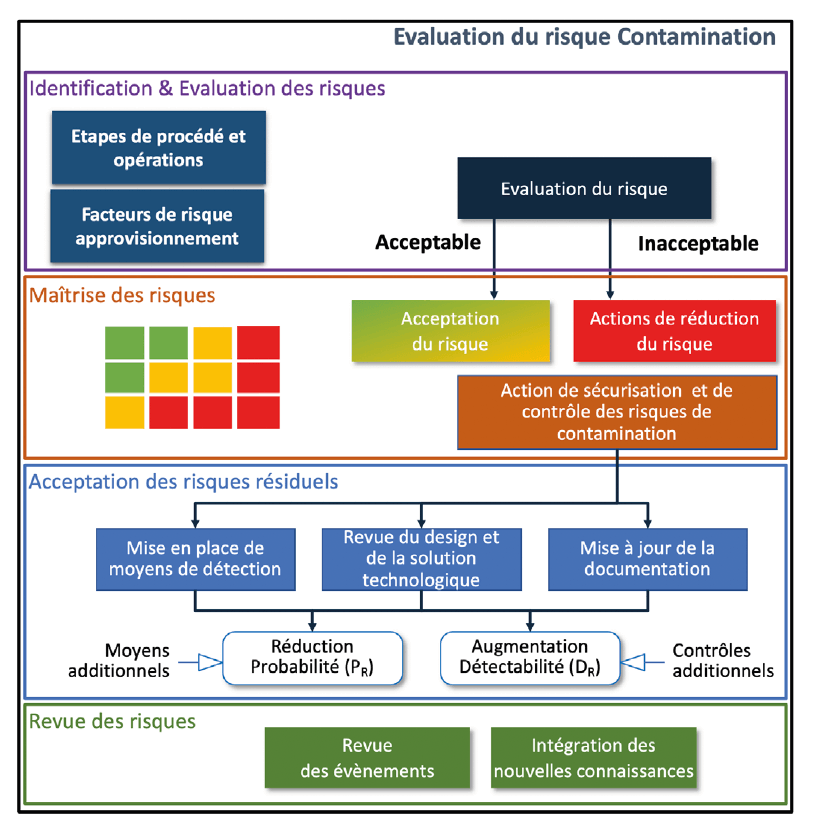
Pour mémoire, l’efficacité d’un exercice QRM est, au-delà de la méthodologie, conditionnée par la connaissance des spécificités du cas d’application de la gestion du risque. Il s’agit de garantir la systématique de recherche de cas de risque, et de stimuler les experts (ou sachants, SME) dans les prises de position à documenter.
Pour cela, la cartographie générique de la problématique (contamination) et son ajustement au cas (lyophilisation) sont une base de questionnement (Risk Question) qui assure rigueur, exhaustivité, rapidité et pertinence. On sert ainsi le second principe du QRM (le niveau d’effort, de formalisme et de documentation du processus QRM doit être proportionné au niveau de risque).
Concrètement, le Mind Map que nous utilisons pour la CCS (voir illustration) permet de guider une compréhension commune du procédé analysé en termes de risques, et ses sous-branches de challenger les sources de risques et d’orienter la définition des moyens de maîtrise.
Dans le cadre de la mise en application sur la lyophilisation, on ressort notamment des risques récurrents pouvant être catégorisés en suivant les différentes opérations préparatoires à la lyophilisation, propres à la lyophilisation et après la lyophilisation. Le tableau ci-dessous cartographie les différents risques typiques des équipements de lyophilisation et la nature des contaminations observables.

Au regard des risques sommaires listés dans le tableau,
des modifications de conception des installations pour minimiser les opérations manuelles permettent de réduire les natures de contamination. L’automatisation avant et après la lyophilisation permet d’améliorer la maîtrise des sources de contamination microbienne. La mise en place de robots de chargement pour remplacer l’opérateur ou de système automatisé de chargement et déchargement avec technologie barrière sont des exemples d’automatisation où l’opérateur est tenu éloigné de la zone critique proche de la porte du lyophilisateur.
La fréquence de nettoyage, de stérilisation, des taux de fuite des lyophilisateurs, le travail sur la gestuelle des opérateurs sont des sujets à évaluer dans le cadre de cette cartographie des risques.
Le monitoring environnemental, en identifiant les points les plus à risques et les types de contrôle, est à mettre en œuvre pour rechercher les différentes natures de contamination.
Au-delà de l’étape de lyophilisation, il sera judicieux, pour maintenir les risques de contamination identifiés dans le tableau, de réaliser le sertissage si possible en ligne, immédiatement après le déchargement (éviter les manipulations intermédiaires, de stockage de flacons bouchés non sertis sur des navettes, chariots). Comme évoqué précédemment ces opérations en aval doivent être sous un Grade A Air Supply, pour la protection des flacons entièrement bouchés où le bouchon n’a pas encore été serti.

4. Quelles bonnes pratiques QRM pour un résultat efficace et robuste ?
La mise en application du Quality Risk Management (QRM) apporte une approche systématique pour permettre la consolidation de la connaissance
sur l’étape de lyophilisation telle que réellement mise en œuvre. L’enjeu est d’identifier toutes les sources de contamination, et de définir les moyens de maîtrise de risques appropriés au contexte, pour, in fine, un très haut niveau de confiance au regard de la sécurité du patient. Plusieurs mécanismes et principes fondent l’approche par le risque, et il est indispensable de les préserver pour assurer un résultat robuste et des dispositions de maîtrise pertinentes.
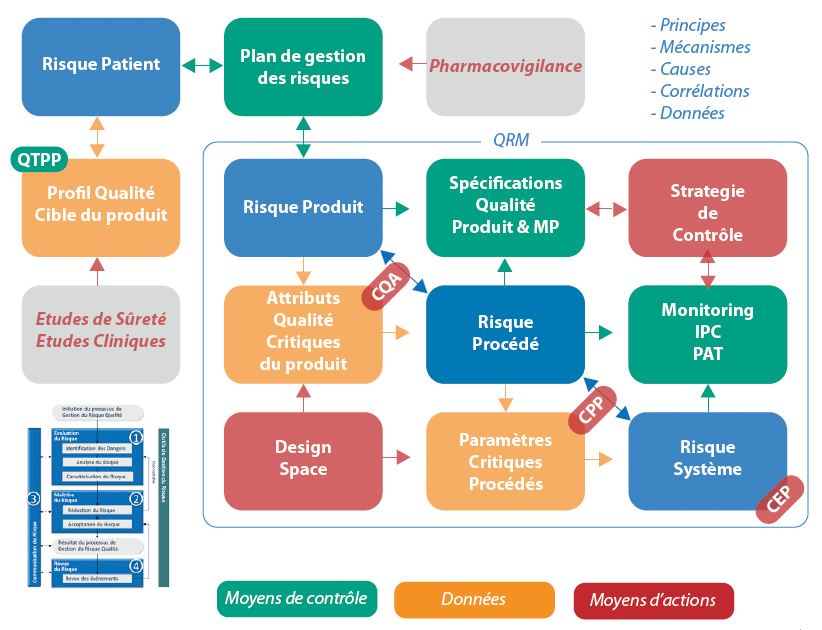
L’intégration de l’exercice dans une approche par étape telle qu’illustrée ci-dessous permet de fonder les rationnels de risques au regard de l’impact sur le produit. Tout d’abord, l’exercice de QRM doit s’inscrire dans un contexte plus global de maîtrise des Critical Quality Attributes (CQA) des produits lyophilisés, pour prendre en compte les spécificités des produits traités, en ligne avec les principes du QbD. L’étape d’analyse de risques “procédé” permet de documenter les paramètres critiques (CPP) du process, et les autres conditions opératoires. Cette étape fournit les clés de lecture des risques systèmes, eux-mêmes liés à la mise en œuvre technique du procédé dans un lyophilisateur donné.
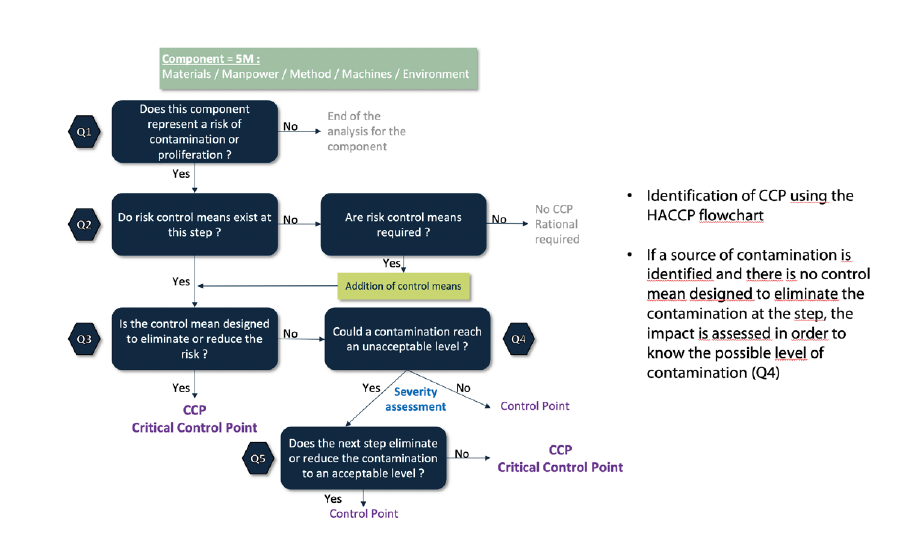
La méthode à utiliser doit être appropriée. D’une manière générale, pour le QRM, nous recommandons d’adapter un outil de base au contexte d’application. Dans le cas de la contamination, il est en général préférable d’adopter, pour base, une approche HACCP. HACCP est définie dans le Codex Alimentarius et reprise par le référentiel ISO 22000:2018 (destiné à la sécurité des denrées alimentaires). Elle apporte de l’efficacité à l’exercice en focalisant la réflexion sur des impacts redoutés. L’identification de CCP (Critical Control Point) permet de cibler les éléments critiques clés à maîtriser. L’illustration ci- après montre la mise en application pour la détermination de la CCS.
La base méthodologique pourrait être l’approche Papillon, si la prise en compte des combinatoires était nécessaire.
Il est important que l’exercice QRM soit alimenté par des données d’entrée disponibles, contrôlées et à jour. Pour mémoire, HACCP rappelle l’importance (étape 5/12) de vérifier que les données d’entrée soient exactes au regard de la réalité du design, du fonctionnement et des pratiques in-situ.
La mise en application du Quality Risk Management (QRM) apporte une systématique robuste pour permettre la consolidation de la connaissance sur l’étape de lyophilisation telle que réellement mise en œuvre. Il est impératif de constituer une (petite) équipe de sachants et pratiquants de l’étape de procédé. Cette équipe doit être maintenue pour toutes les sessions de l’exercice QRM Contamination de la Lyophilisation.
L’exercice de QRM au niveau des équipements de lyophilisation portera notamment sur un travail sur la probabilité de contamination et sur la détectabilité. Comme pour toute analyse de risques pharmaceutiques, il sera primordial de privilégier les actions de maîtrise développant la prévention, en visant la diminution de la probabilité d’apparition de la situation de risque.
L’ensemble des sessions de l’exercice doivent être planifiées et la durée globale allouée peut être utilisée pour limiter les débats d’experts et stimuler la convergence des positions. Si besoin, les points de débat peuvent être hors session et sur base d’une préparation de rationnels. L’animation des exercices doit assurer un haut niveau de partage, dans la transparence, de la connaissance et de l’expérience sur cette opération. Pour assurer la robustesse de l’analyse, la subjectivité des contributeurs, et les biais lors des estimations de risques, doivent être compensés par des outils adaptés (en particulier des échelles de cotation simples confortant les décisions de réduction du risque), et par un alignement de la perception du risque entre les contributeurs. Cet alignement passe par une composante “formation”, pour assurer une même compréhension des fondamentaux du QRM, et par une culture du risque, partagée.
Enfin, la mise en œuvre du QRM doit s’inscrire dans une logique d’amélioration continue. Une fois la CCS définie et adoptée, il s’agit, en s’appuyant sur le système Qualité (PQS), de mettre en place les dispositions pour surveiller la maîtrise de cette étape. Cette surveillance doit notamment s’appuyer sur la vigilance des opérationnels en leur donnant une capacité à détecter des évènements indésirables (déviations, ou évènements “presqu’accident”). Une formation sur l’étape de procédé, mais aussi un partage de l’analyse de risques établie, sont nécessaires.
En synthèse, les Bonnes Pratiques QRM peuvent être rappelées via la check-list ci-dessous.

Conclusion
Dans le cadre des productions de produits lyophilisés stériles, l’opération de lyophilisation est particulièrement critique en termes de risques de contamination, du fait de l’exposition potentielle du produit à des sources multiples de contamination, et notamment de l’apport de conditions environnementales et non de leur retrait.
Au-delà du requis à venir de la future annexe 1 des EU-GMP, il est évident que l’approche QRM, et la mise en pratique structurée et systématique de l’analyse et de la maîtrise des risques, sont indispensables pour guider l’acquisition et la compréhension de la connaissance des phénomènes à risques durant l’opération de lyophilisation.
Pour mettre en œuvre le QRM, l’outillage de la méthode, la structuration et la capitalisation de la connaissance spécifique de cette opération process, dans le contexte propre à chaque site et atelier, sont des clés à la fois de l’efficacité et de la performance de l’exercice d’analyse de risques, mais aussi de la maintenabilité des livrables.
De nos expériences, il nous paraît important que cette mise en application du QRM soit ajustée et animée dans une démarche de culture du risque patient. Il en va de la confiance que nous aurons dans le maintien de la stérilité des produits, et partant, dans la sécurité du patient. Il s’agit d’éviter les principaux écueils, dont certains ont conduit à la révision R1 de ICH Q9 [draft du 18-nov-2021], notamment quant à la lourdeur inappropriée de l’exercice et la subjectivité des contributions.
Partager l’article

Acronymes
CCS Contamination Control Strategy
EMA European Medicines Agency
GMP Good Manufacturing Practices
PQS Pharmaceutical Quality System
QbD Quality by Design
QRM Quality Risk Management
SME Subject Matter Expert
Références
EU GMP Annex 1 Revision: Manufacture of Sterile Medicinal Products (Draft)
ICH Q9 R1 – draft du 18-NOV-2021
ISO 13408-3:2006(fr) : Traitement aseptique des produits de santé — Partie 3: Lyophilisation
ISO 22000:2018 : Systèmes de management de la sécurité des denrées alimentaires
HACCP : Hazard Analysis and Critical Control Point (Codex Alimentarius CXC 1-1969)



