Sommaire
- Dormons tranquille jusqu’en 2100 ?
- Deviations et CAPA Mindset Driving System
- Capa, Déviations, Évènements Qualité
- CAPA et Déviations
- Nouveau QMS ? Attention à ces points pour réussir !
- Validation of the Imaging Technology for a novel microbiological colony counter
- Technologies Barriere & révision de l’Annexe 1 : exigences & réponses opérationnelles pour les industriels
- BPF Annexe 1 et lyophilisation
BPF Annexe 1 et lyophilisation
La production de produits pharmaceutiques est soumise à un ensemble de règles et directives notamment les EU – Guidelines to Good Manufacturing Practice (GMP). Les GMP ont pour but de maîtriser la qualité des produits fabriqués par le détenteur d’une Autorisation de Mise sur le Marché (AMM).
Depuis leurs premières parutions dans les années 1960 / 1970, les GMP ont régulièrement évolué pour prendre en compte les avancées technologiques, mais aussi pour garantir une meilleure qualité des médicaments.
Le médicament stérile, en plus d’exigences qualité inhérentes au médicament, doit répondre à des critères spécifiques garantissant sa stérilité.
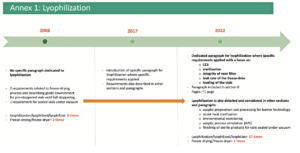
Un premier “draft” a été proposé pour commentaires en décembre 2017 puis un deuxième “draft” en février 2020. Entre la dernière révision de 2008 et le premier “draft”, c’est presque 10 années qui se sont écoulées. Cela constitue une période très longue eu égard aux avancées technologiques et réglementaires du monde pharmaceutique durant ce laps de temps.
A noter que c’est la quatrième révision de l’annexe 1 après celles de 1996, 2003 et 2008.
1. Spécificités concernant la production de produits lyophilisés propres et stériles
La lyophilisation est un procédé complexe caractérisé par un temps en général très long et qui se déroule à une pression inférieure à la pression atmosphérique (sous vide). La lyophilisation nécessite l’utilisation d’un lyophilisateur lui aussi particulièrement complexe qui fait appel à des technologies et à des compétences très spécifiques.
Par ailleurs, pour la production de produits propres et stériles, d’autres procédés “associés” devront être mis en œuvre, certains liés au lyophilisateur, d’autres liés au produit.
– Lié au lyophilisateur : le nettoyage, la stérilisation, le contrôle d’intégrité du(es) filtre(s) à gaz et le contrôle d’intégrité (test de fuite) de l’ensemble de l’installation soumise au vide lors du procédé.
– Lié au produit : les opérations de transfert, de chargement des unités partiellement bouchées (depuis la ligne de remplissage jusqu‘au lyophilisateur), puis le déchargement et le transfert des unités bouchées jusqu’au sertissage.
En résumé, la multiplicité de toutes les opérations inhérentes à la lyophilisation, la durée d’exposition prolongée dans l’environnement des récipients non scellés, les conditions d’utilisation du lyophilisateur avec de fortes contraintes thermiques et mécaniques et les procédés annexes mis en œuvre vont forcément générer des risques accrus de contaminations (microbiologiques, particulaires et croisées) pour le produit.
Une analyse des risques de contamination comparative entre des procédés de répartition aseptiques de formes liquides et de formes lyophilisées permet de mettre en évidence le risque de contamination accru.
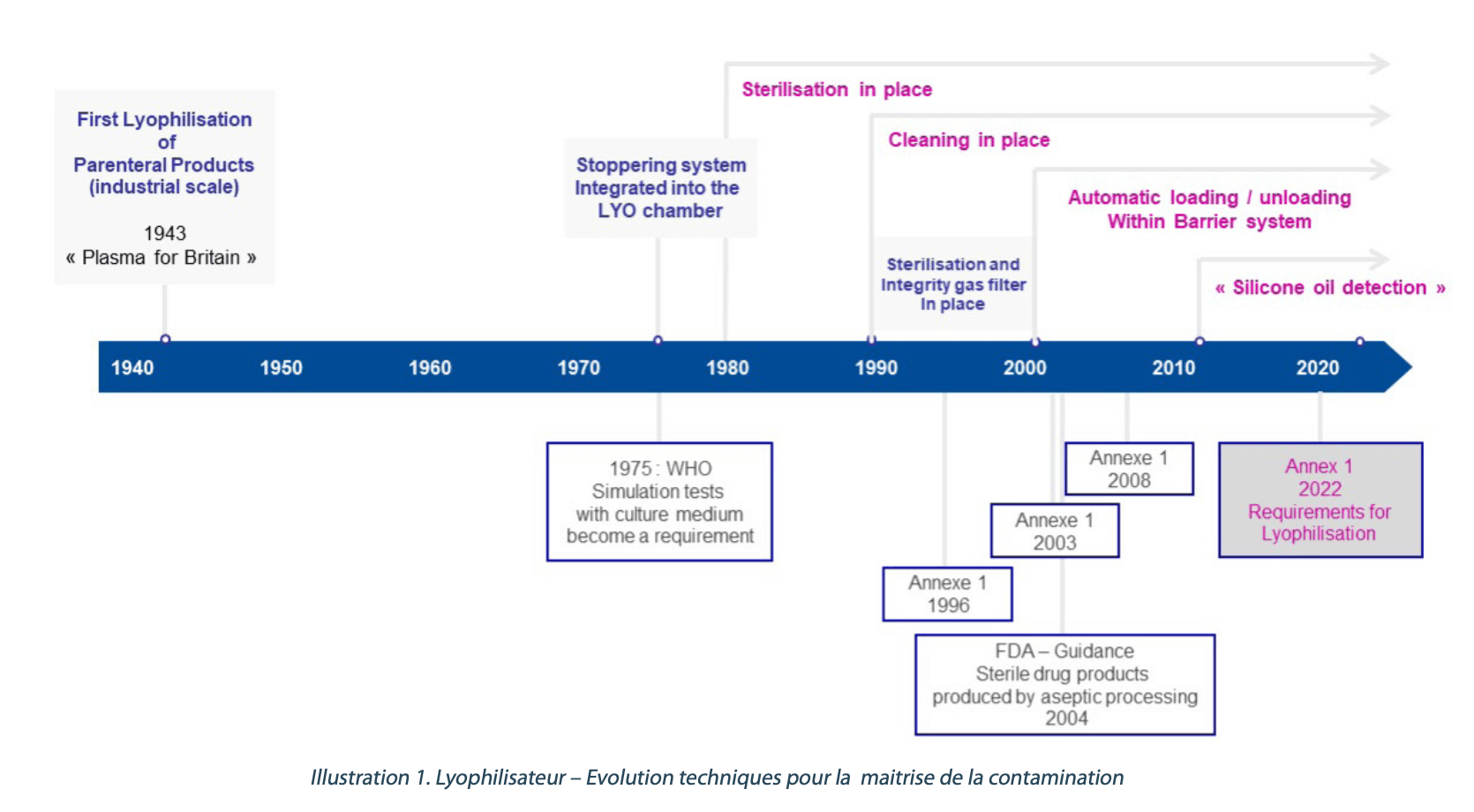
Au cours du temps, les équipementiers ont fait évoluer les installations pour réduire les risques de contaminations. L’illustration 1 montrent les principales avancées techniques des dernières décennies.
2. Annexe 1 et Lyophilisation
Cet aspect de la maîtrise de la contamination pour la production de formes lyophilisées est un des nouveaux points de la nouvelle Annexe 1 des BPF.
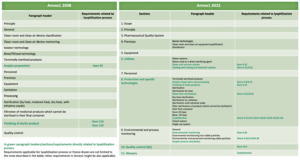
La version en vigueur de l’Annexe 1 (2008) ne fait aucune mention spécifique de la lyophilisation, excepté sur deux sujets :
– Conditions de transferts avant et après lyophilisation ;
– Contrôle du maintien du vide si scellage sous vide.
Dorénavant, dans la nouvelle version, un ensemble de paragraphes dédié à la lyophilisation est essentiellement au sein du chapitre “Production and specific technologies” mais dans d’autres paragraphes, il en est aussi fait mention.
Les tableaux ci-après compare et présente entre les versions 2008 et 2022 et tous les paragraphes dans lesquels la lyophilisation ou le lyophilisateur sont concernés.
Conclusion
Dans la nouvelle Annexe 1 des EU GMP, tous les aspects de l’assurance de stérilité y compris la démarche de “Contamination Control Strategy” y sont abordés. Le niveau des nouvelles exigences va générer la nécessité de mettre en œuvre les toutes dernières évolutions technologiques comme les systèmes de chargement / déchargement automatiques ou semi automatiques associés aux technologies barrières.
Une (R)évolution de nos procédés environnant la lyophilisation va donc se mettre en route que ce soit en matière d’équipements, de procédés, de méthodes avec des impacts plus ou moins forts sur l’organisation et des capacités de production !
Partager l’article

Sandrine Favre