Sommaire
- Quelques bonnes pratiques de validation des procédures analytiques
- ALCOA… avec un A pour Accuracy
- Established Conditions for Analytical Procedures and QbD: current situation and future perspectives for enhanced change management paradigm
- Quand les vibrations des molécules permettent de les doser : la spectroscopie proche infrarouge en action
- Apport des études de stabilités accélérées prédictives (APS) au développement pharmaceutique
- Mise en place de la chimie analytique verte au laboratoire contrôle qualité de la société UPSA
- Évaporation des solutions à base d’alcool : Quels résidus sur les équipements ?
Mise en place de la chimie analytique verte au laboratoire contrôle qualité de la société UPSA
Le Ministère de l’économie, des finances et de la relance décrit la Responsabilité Sociétale Économique (RSE) comme “la contribution des entreprises aux enjeux du développement durable” avec en ligne de mire notamment les conditions de travail ainsi que l’environnement.
Bien avant cette notion récente de RSE, le laboratoire Contrôle Qualité d’UPSA a, dès 2004, introduit un concept de chimie analytique verte afin de prévenir ou de réduire la pollution à sa source.

Le laboratoire Contrôle Qualité s’est ainsi inspiré des principes de la chimie verte(1) afin de développer de nouvelles méthodes analytiques minimisant le risque et maximisant leur efficacité.
L’accent a ainsi été mis sur la suppression des solvants organiques toxiques et du phosphate, la réduction de la quantité de solvants organiques, la réduction de la consommation d’eau et la réduction d’énergie.
1. Conception de la chimie analytique verte pour les laboratoires UPSA
Dans cette étude, 3 solutions alcooliques, représentatives de produits utilisés sur le terrain, ont été étudiées : une solution stérile d’éthanol à 70%, une solution stérile d’isopropanol à 70% et de l’isopropanol pur à 99,6%. Les analyses ont été réalisées via un COT-mètre de marque et modèle Sievers M9 Portable équipé d’un passeur d’échantillons (Suez). Les flacons utilisés pour la préparation des échantillons sont des flacons traités spécifiquement pour les analyses au COT-mètre, certifiés faible teneur en COT.
2. Pourquoi changer les méthodes d’analyses ?
Jusqu’alors, les méthodes analytiques appliquées au laboratoire stipulaient l’utilisation de nombreux solvants organiques comme l’acétonitrile, le méthanol, le toluène, l’hexane, le chloroforme … tant pour les préparations d’échantillons que pour les phases mobiles en CLHP (Chromatographie liquide haute performance) ou CCM (chromatographie sur couche mince) par exemple entraînant une consommation d’atome élevée.
Or tous ces solvants organiques ont des dangers. De fait, sont- ils incontournables ou est-ce une simple habitude des chimistes développant les méthodes d’analyse ?
Par conséquence, l’utilisation de tels réactifs toxiques implique des besoins en sorbonnes de laboratoire consommatrices d’énergie. Ces équipements de protection collective sont néanmoins à considérer comme une mesure palliative et donc insuffisante dans l’esprit chimie verte où les sources de contamination sont à considérer.
L’utilisation aveugle de ce type de réactifs pose question en termes de protection des personnes et de l’environnement, de la préservation des ressources et des traces laissés par les déchets pour les générations futures. Ainsi, à partir de 2004, le défi de rendre les méthodes d’analyse conformes aux principes d’Environnement, d’Hygiène et de Sécurité a été relevé.
Une phase de transformation des méthodes d’analyse s’est enclenchée et s’articule en trois étapes distinctes :
1. Elaboration des 10 règles d’or du développement.
2. Développement et validation de méthodes suivant ces règles et en accord avec les référentiels ICH opposables.
3. Dépôt de variation des méthodes analytiques dans les dossiers d’Autorisation de mise sur le marché auprès des Autorités de Santé.
2.1. Les 10 règles d’or du développement d’une méthode analytique verte
Le développement d’une méthode de chimie analytique verte passe par l’élaboration de principes définissant cette première.
A partir des principes de la chimie verte (1), bien avant l’apparition de publications sur la chimie analytique verte (2, 3, 4), 10 règles d’or ont été édictées afin de réaliser cette transition.
1. Éduction des déchets
Mieux vaut éviter de produire des déchets que d’avoir ensuite à les traiter ou s’en débarrasser.
2. Économie de l’atome
Mise en œuvre de méthodes d’analyses qui réduisent ou suppriment la consommation d’atome (réactifs, solvants, matériels, consommables, …). Tout doit être étudié pour qu’une méthode d’analyse utilise et produise des substances peu ou pas toxiques pour l’homme et l’environnement.
4. Solvants et auxiliaires plus sûrs
Renoncer à utiliser des auxiliaires de synthèse (solvants, agents de séparation, etc.) ou choisir des auxiliaires inoffensifs lorsqu’ils sont nécessaires.
5. Efficacité de la fonction préservée
La méthode analytique préserve l’efficacité de la fonction tout en réduisant la toxicité.
6. Conception de l’efficacité énergétique
La dépense énergétique nécessaire à la mise en application d’une méthode analytique doit être examinée sous l’angle de son incidence sur l’environnement et l’économie et être réduite au minimum. Dans la mesure du possible, les opérations doivent s’effectuer dans les conditions de température et de pression ambiantes.
7. Utilisation d’appareils existants et de ressources renouvelables
La dépense énergétique nécessaire au remplacement d’un appareil ou d’une technologie existante doit être examinée sous l’angle de son incidence sur l’environnement et l’économie.
La dépense énergétique doit intégrer : la destruction du matériel existant et la fabrication de l’appareil de remplacement, la robustesse du nouveau matériel par rapport à l’existant (usure des pièces détachées, nature des composites entrant dans les matériels, consommables, consommation d’électricité, informatique, …).
Utiliser une ressource naturelle ou une matière première renouvelable plutôt que des produits fossiles ou de synthèse, dans la mesure où la technique et l’économie le permettent.
8. Réduction des dérivés ou des extractions
Tout mettre en œuvre pour supprimer ou réduire a minima les extractions avec solvants organiques dans les préparations d’échantillons
Les opérations de séparation et de purification doivent être évitées afin de minimiser la consommation d’énergie et la production des déchets.
9. Conception pour la dégradation
Les produits chimiques utilisés en chimie analytique doivent pouvoir se décomposer en déchets inoffensifs biodégradables. Ils ne doivent pas persister dans l’environnement.
10. Chimie analytique plus sûre pour la prévention des accidents du travail / maladies professionnelles
Les substances chimiques et les matériels entrant dans un processus d’analyse chimique doivent être choisis de façon à prévenir les accidents tels que les émanations dangereuses, explosions et incendies, risque chimique (non-utilisation de composés toxiques ou cancérogènes, mutagènes, reprotoxiques), troubles musculo squelettiques.
2.2. Développement d’une méthode HPLC analytique verte
Le développement d’une méthode”verte” en CLHP, s’articule comme suit :
– Fixation des critères de la méthode CLHP “verte”*
* Les critères pour une méthode CLHP verte ont été la suppression des solvants organiques toxiques et du phosphate, la réduction de la consommation d’énergie, la réduction de la quantité de solvants organiques, le remplacement des solvants organiques par le solvant aqueux (si possible) et la réduction de la consommation d’eau.
– Choix de la technologie
– Recherche et développement
o Bibliographie
– Structure chimique et propriétés physico chimiques des composés à analyser
– Bibliographie des méthodes analytiques existantes pour un composé donné (ex : paracétamol)
o Modélisation d’une méthode potentielle
– Intégration du plan d’échantillonnage
– Préparation des échantillons pour analyse
– Choix de la méthode analytique (CLHP, Chromatographie en phase gazeuse, spectrométrie UV..)
– Choix de la phase mobile (CLHP)
– Choix de la colonne (CLHP)
– Choix du détecteur
o Développement
– Application du modèle – Optimisation
o Validation et rapport
2.3. Résultats
Deux approches ont été réalisées au laboratoire Contrôle Qualité UPSA pour un passage à une chimie analytique verte.
La première approche a été de réduire le nombre de chaînes CLHP et le nombre de méthodes utilisées au laboratoire (pour un volume constant d’analyse) en développant des méthodes avec des couplages de colonnes et/ou en des double détections UV avec des trajets optiques différents. Le couplage de colonnes a permis de développer des méthodes permettant de réduire deux méthodes d’analyses en une seule réduisant ainsi le temps d’occupation et le nombre des chaînes CLHP.
La deuxième approche a été de travailler avec des solutions concentrées en analytes afin de réduire les volumes des solutions essais et de pouvoir analyser des échantillons en accord avec les plans d’échantillonnage. Afin de ne pas saturer les détecteurs, des volumes de l’ordre du 1/10 du μL ont été injectés pour les solutions standards et essais en utilisant des étalons internes pour corriger les variations dues aux très faibles volumes d’injections. En complément, des cellules de 3 mm de trajet optique ont été utilisées. Le développement de méthode CLHP dites vertes est passé par la suppression des phosphates et des solvants organiques toxiques (méthanol et acétonitrile) dans les phases mobiles. Les phosphates ont été remplacés principalement par des succinate, formiate ou acétate.
En outre, il y a eu une réduction importante de la proportion des solvants organiques dans les phases mobiles. Ces dernières contiennent des pourcentages de solvants organiques compris entre 0,8 % et 30 % (plus souvent proche de 3 %) contre 30 % à 85 % dans les phases mobiles précédentes.
Les préparations des solutions essais ont aussi intégré les principes de la chimie analytique verte. Les solvants organiques (méthanol, acétonitrile, hexane, toluène, chloroforme) ont été remplacés par des solutions aqueuses pour la préparation des solutions essais. Les principes de la chimie des solutions ont été mis en œuvre pour solubiliser les échantillons en jouant sur les solubilités conditionnelles des analytes (exemple : solubilité en fonction du pH). Dans quelques cas, de l’éthanol a été ajouté en faible quantité pour aider à la solubilisation des analytes.
Afin de respecter le point 7 des 10 principes de chimie verte analytique, l’option retenue par le laboratoire est de développer avec les dispositifs CLHP existants. Le choix de l’UHPLC (Ultra High Performance Liquid Chromatography) n’a pas été retenu.
Les développements des méthodes ont été effectués avec des colonnes courtes pour réduire les temps d’analyses et en raison de la robustesse des colonnes CLHP contre celles de l’UHPLC.
I. Méthode utilisant des couplages colonnes et/ou une double détection
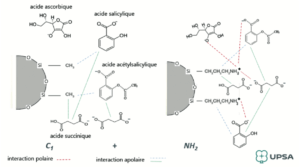
Le couplage de colonnes est une association de colonnes en série. Le principe est de coupler des colonnes ayant des phases stationnaires différentes permettant de séparer les analytes par des chromatographies différentes.
Dans les exemples suivants, des couplages de colonnes de chromatographie en phase inverse (C1, C8 C18 …) avec une colonne de chromatographie échangeuse d’ions (NH2) permettent de réaliser en série de la chromatographie en phase inverse et de la chromatographie par échange d’ion.

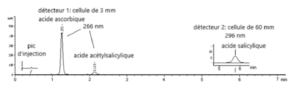
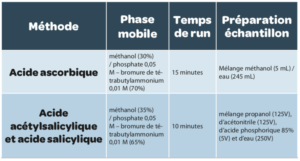
I.1. Dosage des acides acétylsalicylique, salicylique et ascorbique dans des comprimés effervescents
Deux colonnes courtes (50 mm x 3 mm) ont été couplées en série. La première colonne est une colonne C1 (phase inverse) et la seconde est une colonne NH2 (chromatographie ionique).
La phase mobile est un mélange d’éthanol et de tampon succinate de Na 0,05M pH=5,5 (6 % / 94 % v/v). L’acide succinique (composé naturel) permet une élution plus rapide des acides retenus par la colonne NH2. La chaîne CLHP est munie de deux détecteurs (DAD : Diode-Array Detection) en série avec des trajets optiques différents. Le premier détecteur avec un trajet optique de 3 mm permet la quantification de l’acide ascorbique et de l’acide acétylsalicylique à λ=266 nm et le second avec un trajet optique de 60 mm permet la recherche des produits de dégradation comme l’acide salicylique à λ=296 nm.
Les quantifications de ces trois analytes sont effectuées sur un même run de 7 minutes. La préparation de l’échantillon s’effectue dans un mélange d’éthanol / 0,1 M HCl (5% / 95 % : v/v).
Cette méthode a remplacé deux méthodes CLHP dosant pour l’une l’acide ascorbique et pour l’autre l’acide acétylsalicylique et l’acide salicylique dont les caractéristiques d’analyse sont détaillées ci- dessous :
Les gains du développement d’une méthode analytique “verte” sont multiples : nombre de méthodes avec une conséquence directe sur le parc CLHP nécessaire, temps d’analyse et avant tout, suppression de réactifs chimiques néfastes pour l’homme et l’environnement.
I. 2. Dosage du paracétamol, de la phéniramine et de l’acide ascorbique dans des poudres en sachets.
Dans ce cadre, deux colonnes ont été couplées en série. La première colonne est une colonne C18 (150 mm x 4,6 mm) et la seconde est une colonne NH2 (50 mm x 4.6 mm). La phase mobile est un mélange d’éthanol et d’un tampon succinate de sodium 0,05M pH=5,5 (19 % / 81 % v/v).
La chaîne CLHP est munie de deux détecteurs (DAD) en série avec des trajets optiques différents (3 mm pour la quantification du paracétamol et de l’acide ascorbique – 60 mm pour quantification de la phéniramine). Les quantifications des trois analytes sont effectuées sur un même run (13 minutes). La préparation de l’échantillon s’effectue dans de l’eau purifiée.
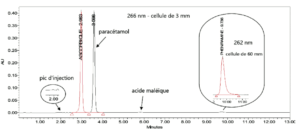
Les gains ainsi obtenus sont identiques à ceux obtenus dans l’exemple précédent.
I.3. Méthode d’analyse utilisant un étalon interne
– Dosage de l’acide ascorbique dans des comprimés effervescents. Cette méthode a été développée pour réduire au maximum la consommation du solvant de préparation de la solution pour analyse. La préparation de l’échantillon s’effectue dans de l’eau purifiée contenant de l’acétylcystéine comme anti oxydant.
La concentration finale en acide ascorbique des solutions échantillon est de 20 mg/mL. Une telle concentration en acide ascorbique sature les détecteurs DAD classiques ayant un trajet optique de 10 mm pour des volumes d’injections de quelques μL. L’utilisation d’un étalon interne (acésulfame de potassium) a permis de s’affranchir des variations liées à des volumes d’injections de l’ordre du 1/10 de μL. La colonne utilisée dans ce cas est une colonne NH2 (50 mm x 3 mm). La phase mobile est un mélange d’éthanol et d’un tampon acétate de sodium 0,05M/acide acétique 0,05M (10 % / 90 % v/v). Le temps d’analyse par CLHP est de 14 minutes. Le volume d’injection est de 0,1 μL.
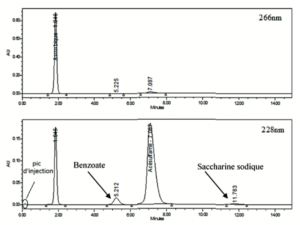
Le gain dans ce cadre correspond à l’utilisation de verrerie de laboratoire de plus faible volume ayant pour conséquence directe une consommation d’eau purifiée réduite ; la manipulation chronique de plus petits contenants réduisant le risque d’apparition de troubles musculosquelettiques.
I.4. En quoi ces nouvelles méthodes développées au Laboratoire de Contrôle respectent les 10 principes de chimie analytique verte ?
Les méthodes développées ont répondu aux règles de chimie analytique verte initialement fixées :
1) Réduction des déchets : moins de phases mobiles, moins de consommation volumes de solutions essais … ). Les nouvelles méthodes CLHP ont permis la réduction du temps d’analyse en utilisant des colonnes courtes ou des couplages de courtes colonnes. Réduction des volumes de solvants (eau ou solvants organiques) pour la préparation de l’échantillon : utilisation d’étalons internes permettant d’injecter des petits volumes (0,1 μL à 0,4 μL). Couplage de détecteur permettant de coupler des méthodes d’analyses en une seule.
2) Economie d’atome : baisse importante de consommation de solvant, moins de consommation de colonne CLHP). Mise en œuvre de méthodes d’analyses avec réduction de solvants organiques entrant dans les phases mobiles et remplacement des solvants organiques par des solvants aqueux dans les préparations d’échantillons.
(1) : développements, validations et dépôts dans dossiers d’AMM d’une méthode générale du dosage du paracétamol
(2) : mise en application méthode après retour Agences et continuité des développements et validations pour autres analytes
(3): volume résiduel de méthanol lié à l’analyse des matières premières selon les méthodes PE (6).
3) Pas ou moins de produits chimiques dangereux
Suppression des solvants organiques toxiques (méthanol, acétonitrile, hexane, toluène, chloroforme…)
4) Solvants et auxiliaires plus sûrs
L’eau, l’éthanol et l’isopropanol ont remplacé le méthanol, l’acétonitrile, l’hexane, le toluène, le chloroforme…
5) Concevoir pour préserver l’efficacité de la fonction
Les méthodes alternatives sont plus robustes que celles remplacées tout en augmentant les précision, répétabilité et exactitude. 6)Conception de l’efficacité énergétique
. En utilisant une chaîne HPLC avec deux détecteurs pour remplacer deux chaînes CLHP.
. En réduisant les temps d’analyse par CLHP.
. En ayant des méthodes robustes en termes de consommation de colonnes CLHP.
. En développant des méthodes d’analyses ne nécessitant pas de hottes de laboratoire pour la préparation des échantillons pour analyses.
. En développant des méthodes CLHP à température ambiante (colonne CLHP et préparation des échantillons).
7) Utilisation d’appareils existants et de ressources renouvelables
Le développement a été réalisé avec des équipements existants (utilisation des chaînes CLHP existantes et non au profit de chaîne UHPLC). Durabilité des matériaux par le choix de petites colonnes CLHP plus robustes par rapport à des colonnes UHPLC (tests comparatifs réalisés au laboratoire de contrôle : durabilité des colonnes CLHP vs UHPLC : 5 à 50 fois plus d’injections pour les colonnes CLHP). L’eau et l’éthanol (ressource naturelle ou une matière première renouvelable) ont substitué l’acétonitrile et le méthanol, très largement utilisés en CLHP, car issu de synthèses chimiques. L’acétonitrile est un sous-produit de la production de l’acrylonitrile lui-même issu de la pétrochimie n’est pas une ressource renouvelable. Le méthanol est produit industriellement car il n’est pas présent en quantité importante dans la nature.
8) Réduire les dérivés ou les extractions
Les opérations de séparation et de purification ont été évitées afin de minimiser la consommation d’énergie et la production des déchets.
9) Conception pour la dégradation
Des solvants aqueux ont remplacé le méthanol, l’acétonitrile, le toluène, le chloroforme et l’éther pour la préparation des échantillons pour analyses. Les solutions échantillons sont pour la plupart préparées dans de l’eau. La solubilisation des analytes a été optimisée en agissant essentiellement sur le pH. Lorsque cela a été nécessaire, de l’éthanol a été ajouté dans les phases aqueuses pour augmenter la solubilisation de certains composés. Les tampons phosphates des phases mobiles ont été remplacés par des acétate, formiate ou succinate (composés organiques naturels et non toxiques).
10) Chimie analytique plus sûre pour la prévention des accidents
La préparation en méthode pondérable a remplacé le volumétrique. Les préparations sont ainsi faites dans des erlenmeyers en remplacement des fioles supprimant par là même les agitations manuelles. La non-utilisation de composés toxiques ou cancérogènes, mutagènes, reprotoxiques par le remplacement des solvants méthanol*, acétonitrile*, toluène* et chloroforme* par des solvants aqueux dans lesquels peut être ajouté de l’éthanol si besoin.
*Méthanol classé toxique avec risque avéré d’effets graves pour les organes, l’acétonitrile classé Catégorie D – Matières toxiques et infectieuses, 1. Matières ayant des effets toxiques immédiats et graves par l’autorité de santé du Canada, le toluène classé mutagène, cancérogène, reprotoxique (CMR), le chloroforme classé Toxique et CMR.
Prise en compte des troubles musculo squelettiques dans la préparation des échantillons pour analyse (suppression des agitations manuelles, suppression des broyats de comprimés au mortier).
Conclusions
A partir de 2004, le laboratoire Contrôle Qualité de la société UPSA a développé plusieurs méthodes d’analyses permettant la suppression des solvants organiques toxiques et le phosphate, l’utilisation de composés non persistants ou bio- accumulateur dans les organismes ou l’environnement, la réduction de la consommation d’énergie, la réduction de la quantité de solvants organiques, le remplacement des solvants organiques par un solvant aqueux si possible, la réduction de la consommation d’eau et l’utilisation des dispositifs existants.
Au total, une douzaine de méthode a été développée pour les dosages des principes actifs, des produits de dégradation et des conservateurs pour plus de cinquante formules de produits finis. Toutes ces méthodes ont été déposées dans les dossiers d’AMM (autorisation de mise sur le marché) correspondants et mises en application dès approbation des Autorités de Santé. Tous ces développements ont été réalisés sans investir. Les seuls achats effectués concernent quatre détecteurs avec des longueurs optiques différentes. Ces détecteurs permettent le regroupement de méthodes analytiques sur une seule chaîne CLHP.
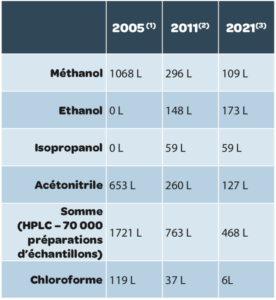
Ce travail a permis de réduire la consommation globale de solvant organique (1721 L de solvants organiques en 2005 contre 468 L en 2016) et des baisses très significatives des solvants toxiques (exemple : 1068 L de méthanol en 2005 contre 109 L en 2016).
Le nombre de chaînes CLHP est passé de 22 chaînes en 2005 à 16 en 2016 puis à 12 en 2021 pour les analyses des produits finis pour un volume d’analyse a minima constant voire croissant.
La diminution du nombre de chaînes CLHP a permis des baisses de consommation en énergie et des consommables ainsi qu’une simplification en termes de maintenance et de métrologie.
Le choix de développement de méthodes analytiques par CLHP a été fait du fait de la présence de ce type de matériel au laboratoire. L’UHPLC n’a pas été retenu pour plusieurs raisons : problématique de robustesse des colonnes UHPLC, consommables plus importants pour la maintenance des systèmes et des saturations de détecteurs (du fait de pic plus fin) impliquant des étapes de dilutions supplémentaires lors de la préparation des solutions essais.
A la question : “Pouvons-nous développer des méthodes analytiques soucieuses des conditions de travail et soucieuses de l’environnement ?“, la réponse est très certainement oui.
Partager l’article
Myriam DESCAZAL – François-Xavier MARTIN – – Mylène RABINEAU – Amandine VISENTIN
siegfried.steinbruckner@upsa-ph.com
Références
1: PAUL T. ANASTAS – JOHN C. WARNER, Green Chemistry: Theory and Practice, Oxford University Press, New York, 1998.
2: MIGUEL GUARDIA AND SERGIO ARMENTA, Green Analytical Chemistry, 1st Edition, Volume 57, Elsevier, 2010
3: MIGUEL DE LA GUARDIA ET SALVADOR GARRIGUES, Handbook of Green Analytical Chemistry, 1st Edition, Wiley, 2012
4: KUROWSKA – SUSDORFA A., ZWIERŻDŻYŃSKI M., MARTINOVIĆ BEVANDA A., TALIĆ S., IVANKOVIĆ A., JUSTYNA PŁOTKA – WASYLKA – Green analytical chemistry: Social dimension and teaching, TrAC Trends in Analytical Chemistry, 111, February 2019, PP 185-196
5: MARTIN F-X., Suppression des solvants toxiques et diminution de la consommation de solvants, Troisième journée de conférences du club Sud-Ouest de l’AFSEP, 11/2012.
6: Pharmacopée Européenne.