Sommaire
- Quelques bonnes pratiques de validation des procédures analytiques
- ALCOA… avec un A pour Accuracy
- Established Conditions for Analytical Procedures and QbD: current situation and future perspectives for enhanced change management paradigm
- Quand les vibrations des molécules permettent de les doser : la spectroscopie proche infrarouge en action
- Apport des études de stabilités accélérées prédictives (APS) au développement pharmaceutique
- Mise en place de la chimie analytique verte au laboratoire contrôle qualité de la société UPSA
- Évaporation des solutions à base d’alcool : Quels résidus sur les équipements ?
Quand les vibrations des molécules permettent de les doser : la spectroscopie proche infrarouge en action
C’est à la base une évidence sensorielle partagée par chacun que de connaître le monde qui nous entoure en l’observant visuellement… à condition qu’il soit éclairé ! Et si l’on nous dit qu’il est possible de “voir” les molécules en les éclairant, l’évidence s’évanouit car chacun sait qu’il est impossible de voir de si petits objets de cette façon. Et pourtant…

C’est bien ce que cet article propose d’illustrer, en tirant profit du fait que le monde qui nous entoure, et déjà les atomes constitutifs des molécules, est un monde en perpétuel mouvement. Les atomes s’associent les uns aux autres au travers de liaisons chimiques animées de mouvements vibratoires de très faible amplitude mais de très haute fréquence (1014 Hz). Et comme la lumière possède aussi cette nature vibratoire, lumière et molécules sont en capacité d’interagir, de résonner. C’est ce qu’ont bien compris les physiciens qui ont développé les spectroscopies vibrationnelles (mIR, pIR, Raman) qui mesurent, collectent et interprètent ces signaux porteurs d’informations. Cet article va se concentrer sur l’une d’entre elles, la spectroscopie proche infrarouge (pIR), moins familière que la spectroscopie moyen Infrarouge (communément appelée Infrarouge) car elle nécessite plus d’efforts pour interpréter l’origine des signaux. En spectroscopie mIR, les signaux mesurés proviennent de modes fondamentaux de vibrations, ils sont majoritairement intenses et fins, et il suffit le plus souvent de se reporter à une base de données pour identifier les liaisons responsables des spectres obtenus.
En spectroscopie pIR les signaux observés sont peu spécifiques. La raison en est que ces signaux proviennent de liaisons chimiques communes à la totalité des molécules organiques : les liaisons CH, OH, NH, SH. Ce que capte le spectrophotomètre pIR est une suite de mélanges provenant de la diversité moléculaire de l’échantillon observé (les liaisons CH de toutes les molécules par ex), à laquelle se superposent des mélanges des modes de vibrations eux-mêmes (élongation, torsion, rotation, cisaillement, etc.) et de leurs harmoniques. Si un spectre pIR est un objet complexe à manipuler, sa complexité recèle en contrepartie une vraie richesse, celle de délivrer deux types de messages : une première information sur la nature chimique de l’échantillon et une seconde sur son état physique. Encore faut-il pouvoir extraire ces informations ! C’est là que l’usage du pIR se démarque de celui du mIR, utilisé dans tous les laboratoires d’analyse. En spectroscopie pIR, il faut nécessairement traiter au préalable les signaux pour en extraire l’information adéquate contenue dans ces mélanges. La chimiométrie, discipline composite de mathématiques, statistiques, informatique en mesure de développer des algorithmes de traitement des signaux complexes pour en extraire l’information utile, est l’incontournable compagnon d’usage de la spectroscopie pIR. Cette contrainte culturelle est certainement une première “bonne” raison de son moindre attrait auprès des analystes. S’intéresser au décodage des vibrations des liaisons chimiques par la spectroscopie pIR ouvre sur un univers étonnant car il permet non seulement d’identifier la nature chimique des produits dans un échantillon, par exemple le principe actif et les excipients dans un comprimé, mais renseigne aussi sur un état physique, par exemple l’état amorphe ou telle forme cristalline de ce principe actif dans ce comprimé (parfois primordial pour la propriété intellectuelle) voire de sa provenance (sur quel site a été fabriqué ce comprimé). Voilà pourquoi cet outil analytique, plus exigeant culturellement dans son usage, est fort apprécié de ceux qui veulent en savoir plus. Et comme la lumière va vite, qu’elle ne fait qu’effleurer les échantillons sans les modifier, elle est également fort appréciée pour cette rapidité à livrer de l’information sur des échantillons tels quels.
Pour atteindre ces performances analytiques, il reste une étape à franchir, relier la position spectrale et la part de l’intensité des signaux mesurés à la propriété recherchée. Si l’on veut doser un composé au sein de son environnement, il convient de s’assurer au préalable de son identité. Attribuer des signaux à une espèce donnée est une opération de classification réalisable à partir d’algorithmes spécialisés.
Si l’on peut accéder ainsi, à partir d’un spectre mesuré sur un échantillon tel quel, sans avoir eu besoin de lui faire subir une quelconque préparation (une dissolution par ex) préalable à la mesure, il est alors tout à fait envisageable de pousser l’analyse plus loin, pour savoir combien de milligrammes de principe actif (par exemple) sont contenus dans ce comprimé. Et ce, à la vitesse (ou presque) de la lumière. C’est cet aspect quantitatif qui va être survolé dans la suite de cet article. Si les applications présentées sont issues de l’expérience acquise dans l’industrie pharmaceutique, elles sont bien sûr tout à fait applicables aux industries chimique, cosmétique, et agro-alimentaire. Si les applications présentées mettent à l’évidence l’accent sur la matière solide (des poudres, des comprimés) c’est que l’on tire profit d’une propriété spécifique du rayonnement pIR. Très peu absorbé par la matière, il peut y pénétrer suffisamment pour en explorer une épaisseur conséquente, celle d’un comprimé par exemple, ce qui rend accessible plusieurs types d’applications qualitatives (identification, imagerie) et quantitatives bien différentes des techniques conventionnelles.
1. Doser l’eau dans un flacon de poudre
Toutes les poudres étant issues d’un procédé de séchage, doser l’eau résiduelle est une opération courante dans les laboratoires d’analyse pour connaître l’état de la poudre, qu’elle soit fraîchement produite ou à l’issue d’études de stabilité destinées à préciser l’hygroscopicité de ce type de poudre. Deux techniques sont couramment déployées dans ce but, la réaction de Karl Fisher et la coulométrie. Toutes deux nécessitent une mise en œuvre au-delà de la dizaine de minutes. Alors que poser le flacon sur un spectrophotomètre et obtenir l’information en quelques secondes, sans avoir à réaliser un prélèvement ni peser quoi que ce soit, relève de l’efficacité en plus du confort.`
Reste à étalonner le système, en sélectionnant les bandes de l’eau dans le spectre pIR et en associant de façon convenable les signaux sélectionnés avec une gamme d’échantillons contenant des quantités croissantes d’eau, quantités précisément mesurées par une technique de référence. L’étalonnage est une démarche classique, et totalement incontournable, en chimie analytique.
En guise de résultat, l’analyste ou un technicien non spécialiste, n’aura qu’à poser un flacon de poudre sur l’analyseur pIR, attendre dix secondes et voir apparaître à l’écran ou sur un ticket la teneur en eau de son échantillon.
Si l’on excepte le temps consacré au développement de la méthode, la performance de mesurage n’a quasiment pas de concurrent dans les techniques conventionnelles. Certains laboratoires ont remplacé plusieurs appareils de Karl Fisher par un spectrophotomètre pIR.
2. Doser le principe actif dans un comprimé
Encore une opération classique et fréquente en développement et production pharmaceutique.
La démarche de développement de l’outil analytique(1,2,3), ici la spectroscopie pIR, suit le même cheminement : il convient tout d’abord de sélectionner les bandes ou la/les parties du spectre pIR susceptibles de contenir l’information se rapportant au principe actif contenu dans les comprimés. Puis de préparer des séries de comprimés témoins contenant des quantités croissantes du principe actif à doser, d’acquérir les spectres de tous ces échantillons avant de déterminer individuellement leur contenu par une méthode de référence (souvent la chromatographie liquide haute performance, HPLC, pour les formes solides) et de construire le modèle convenable associant les signaux pIR aux teneurs croissantes en principe actif. L’ensemble de la démarche est plus chronophage que pour les méthodes conventionnelles car elle demande une attention particulière portée à l’échantillonnage.
La grande majorité des techniques de dosage utilisées dans les laboratoires (HPLC, spectroscopie UV Visible) opère sur des échantillons en solution, ce qui exclut toute information sur l’état solide d’origine. En spectroscopie pIR, et sur des échantillons solides, comme les signaux portent deux types d’informations, nature chimique et état solide, l’analyste chargé de modéliser une corrélation se doit de penser aux interférences possibles entre ces sources s’il veut obtenir un modèle robuste.. Les signaux complexes collectés, pouvant varier au gré de contributions diverses, sont prétraités mathématiquement pour faire un tri, une sélection, mais à condition d’avoir rencontré des échantillons contenant ces variabilités plausibles. Il faudra donc intégrer, aux étapes de validation, des échantillons à la valeur nominale fabriqués par exemple à différentes périodes de l’année pour intégrer des petites variations de paramétrage des lignes de fabrication, des petites variations des lots de matières premières, voire sur des matériels ou des opérateurs différents, toutes choses susceptibles d’interférer dans un sens ou un autre et affecter la robustesse de la prédiction quantitative.
Dans le métier de la modélisation, l’usage est de parler de modèle et de prédiction.
Ce que l’on ne fait pas pour les techniques de dosage conventionnelles en solution, qui requièrent quasiment toutes un étalonnage (donc un modèle), mais comme l’algorithme de traitement est la linéarité, algorithme univarié le plus simple, sensible essentiellement à la précision des pesées et des volumes, il n’est pas pensé comme tel.
Ces considérations amènent ainsi à se poser la question du nombre d’échantillons nécessaires pour élaborer un modèle. L’expérience(2) montre que le nombre n’est pas très élevé. Pour construire un modèle dédié au test d’uniformité de teneur des comprimés en sortie de production, un classique du genre, il aura fallu seulement 85 comprimés pour réaliser un étalonnage sur une gamme comportant sept niveaux de concentration entre 70% et 130% de la valeur nominale, à raison de cinq comprimés par niveau de gamme. Pour densifier le modèle autour de la valeur nominale, des échantillons de dix lots, issus de deux années de production, à raison de cinq comprimés par lot, ont été injectés dans le modèle. Soit cinquante comprimés.
La difficulté ne réside pas tant dans le nombre d’échantillons que dans leur qualité. La sensibilité de cette spectroscopie à l’état physique des échantillons est tout à la fois une opportunité et une difficulté quand il faut obtenir des témoins différents de la valeur nominale, ce qui est le cas pour l’étape d’étalonnage. Il convient qu’ils soient préparés sur du matériel aussi proche que possible de celui utilisé en production. Et cela mobilise du temps et des moyens adéquats. Tout comme le recours à une méthode de référence pour assurer la qualité des témoins, dans ce cas l’HPLC. La modélisation nécessite de tester différents “réglages” des algorithmes, donc différents modèles avant de sélectionner le meilleur, sur des critères de performances statistiques.
Au final, la performance analytique est attrayante. Pour doser dix comprimés en routine, il faut environ 300 minutes (5h) par HPLC avec destruction des comprimés dosés, consommation de solvants et réactifs, mais seulement 15 minutes par pIR, sans solvants ni réactifs, et des comprimés intacts, disponibles au besoin pour un autre test. Pour l’opérateur, la technicité est ultra simple : disposer des comprimés sur un passeur d’échantillons, lancer la séquence d’acquisition, récupérer le rapport sur l’imprimante. Tout l’effort repose sur le développeur. L’utilisateur en routine dispose ainsi d’une méthode analytique simple à mettre en œuvre tout en étant plus respectueuse de l’environnement, qui s’insère naturellement dans un contexte de responsabilité sociétale d’entreprise (RSE).
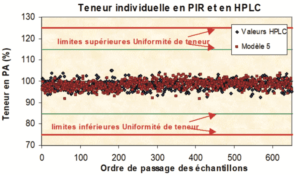
A titre d’illustration, voici ce que donne la comparaison d’un dosage par spectroscopie pIR puis par la méthode de référence, en l’occurrence l’HPLC, sur 1.000 comprimés dragéifiés prélevés sur 3 années de production d’une spécialité pharmaceutique.
Chaque comprimé a été dosé individuellement de deux façons : d’abord par spectroscopie (non destructive) puis par la méthode (destructive) de référence. Cet exemple illustre aussi le fait que l’enrobage de comprimés n’interdit pas de sonder l’intérieur, sous la couche d’enrobage.
Le prix de cette performance définit en pratique son périmètre d’application. Pour une vision plus juste, il convient de préciser que la mise au point d’une telle méthode nécessite au minimum du temps, de l’ordre de quelques semaines, la culture et l’expertise spécifique du pIR (spectroscopie et chimiométrie) et une grande attention aux facteurs d’influence(3). L’analyste en charge de ce type d’outil est en mesure de détecter un biais, une dérive mais sans pouvoir en identifier aisément le motif. Il faut alors mener l’enquête pour impliquer tel ou tel changement, souvent opéré à son insu par le fabricant.
Dans une pratique industrielle, il faut aussi régulièrement s’assurer que le modèle n’est pas dépassé par des changements d’environnement ou de pratiques. Il y a donc un suivi des modèles à mettre en place avec parfois une maintenance corrective nécessaire.
Ces éléments font que cette approche quantitative convient parfaitement aux grandes séries, fréquentes, bien stabilisées dans leur procédé de fabrication. C’est le cas de certaines productions. A contrario, ce n’est pas la méthode de choix dans un environnement de développement de formulations où les ingrédients changent continuellement en qualité et/ou quantité d’une série à l’autre. Reste que la lumière va vite, est éco responsable, et que les informations qu’elle nous rapporte valent l’effort consenti dans certains cas.
3. Dosage en temps réel en sortie de ligne de fabrication
Cette application présente l’intérêt de fabriquer et doser dans le même mouvement, sans avoir à attendre le retour d’analyses d’un laboratoire de contrôle. Elle constitue une évolution prévisible, et déjà accessible, de l’analytique de laboratoire qui devient analytique de procédé, plus connue sous son sigle PAT (process analytical technology), fortement promue par la FDA dès 2004(5) pour maîtriser la qualité d’une production pendant qu’elle s’opère plutôt que de constater le résultat final sans pouvoir corriger la trajectoire du procédé. Le défi est de concevoir des capteurs en mesure d’acquérir très rapidement des spectres sur des échantillons en mouvement sur un convoyeur (tapis roulant)(6).
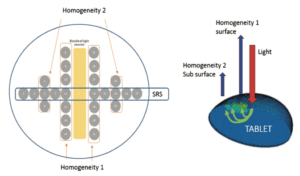
Cela est possible en recourant, dans l’exemple présenté (with permission of the authors), à plusieurs fibres optiques intégrées dans une sonde, chacune collectant les signaux d’une partie de la surface de l’échantillon. Par réflexion diffuse au sein de l’échantillon, chaque fibre retourne une information de la zone qu’elle observe, l’ensemble formant une image basse résolution.
Le dispositif mentionné est en mesure de “capturer” 26 images distinctes d’un échantillon en mouvement et d’autoriser une prise de décision en moins de 100 msec. Cette rapidité de capture et de traitement permet d’éliminer en temps réel les comprimés hors spécification et de ne conditionner que des produits testés conformes. En sortie de machine à comprimer, les comprimés sont alignés sur un tapis roulant, le convoyeur. Une caméra optique détecte si chaque comprimé se présente sur une même face ; si ce n’est pas le cas, un dispositif d’éjection le renvoie en amont jusqu’à ce qu’il revienne sous la bonne présentation. Il passe ensuite sous la sonde pIR qui, elle, va certifier ou non sa conformité avant conditionnement. La sonde multifibre peut renvoyer deux informations : une, qualitative, sur l’homogénéité de répartition des composants au sein de chaque comprimé, l’autre quantitative, la teneur en substance active de chaque comprimé. Seuls les comprimés conformes aux spécifications continuent leur route pour être conditionnés.
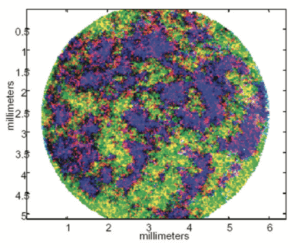
Ces quelques exemples illustrent ce que peut déjà apporter la spectroscopie vibrationnelle pIR, qui permet de visualiser et différencier les constituants chimiques d’un échantillon, que ce soit au laboratoire par la spectroscopie, ou de façon plus spectaculaire au travers de l’imagerie hyperspectrale(4) (tel ce comprimé où apparaissent en fausse couleurs le principe actif en rouge, le lactose en bleu et la maltodextrine en vert), et enfin en ligne par une imagerie basse résolution en temps réel. L’application de ces outils à bon escient est un gage de valeurs ajoutées.
Ce qu’il faut aussi retenir est que ces outils performants font entrer la chimie analytique dans une autre pratique que celle des analystes recourant à la panoplie commune des laboratoires de contrôle. Non seulement il leur faut apprendre à maîtriser la chimiométrie pour en tirer le meilleur profit, mais en plus ces outils vont les faire sortir des laboratoires de contrôle pour rejoindre les ateliers de fabrication et devenir des experts incontournables du contrôle continu et des procédés de fabrication continue(7). En sachant que tant la FDA que l’EMA, pour ne citer que ces deux grandes Agences, sont en capacité experte de recevoir et accepter des dossiers d’AMM et des variations(8).
Partager l’article

Yves Michel Ginot – Servier
Après un PhD en Biophysique (Paris VI), quelques années de recherche fondamentale et 3 décennies de développement analytique pour les dossiers AMM chez Servier, un passage par l’expertise à la Ph Fr, la présidence de deux commissions SFSTP sur les spectroscopies vibrationnelles, Y.M. Ginot s’intéresse aux voies d’innovation dans le contrôle continu (en temps réel) qui débouchent sur les procédés de fabrication continue. Il est également Président de Le Studium, Institut d’Etudes Avancées en Région Centre Val de Loire.
yves-michel.ginot@servier.com

Yoann Gut – Servier
Ingénieur Polytech Orléans, PhD en spectrométrie de masse et traitement du signal, Y. Gut développe le traitement du signal, l’analyse multivariée, dans les différentes applications de spectroscopies vibrationnelles, imageries hyperspectrales, et le contrôle continu de procédés de fabrication pharmaceutiques et/ou chimique au sein du Pôle d’expertise Développement Pharmaceutique de Servier à Orléans.
yoann.gut@servier.com
Références
(1) Le dosage par spectroscopie proche infrarouge. Application au test de l’uniformité de teneur des comprimés. I. Méthodologie Commission SFSTP, Y.-M. Ginot P. Bernard-Moulin, R. Cinier, F. Despagne, J.P. Dubost, L. Francès, M. Le Bihan, M. Le Page, A. Michelet, L. Meunier, G. Monteillet, A. Quintana , A. Rieutord, I. Storme, F. Thevenot, E. Ziemons STP PHARMA PRATIQUES – volume 20 – N° 2 – mars-avril 2010
(2) Tablet potency of Tianeptine in coated tablets by near infrared spectroscopy: model optimization, calibration transfer and confidence intervals Journal of pharmaceutical and biomedical analysis, 54 (2011) 510 – 516 Mathieu Boiret, Loïc Meunier, Yves-Michel Ginot
(3) Le dosage par spectroscopie proche infrarouge. Application au test de l’uniformité de teneur des comprimés. II. Commission SFSTP, Y.-M. Ginot
P. Bernard-Moulin, M. Boiret, R. Cinier, F. Despagne, J.P. Dubost, L. Frances, M. Le Page, A. Michelet, L. Meunier (†), E. Ziemons
STP Pharma Pratiques – volume 24 – N° 1 – janvier-février 2014
(4) Chemical imaging: an essential contribution to assess pharmaceutical quality, STP Pharma Pratiques , mai/juin 2019 – n°03 p24-37, STP Pharma Pratiques, juillet/août 2019 – n°04, p. p38-55, Commission SFSTP, Y.-M. Ginot, F. Bonnier , F. Chauchard, Y.Gut, A. Michelet, A. Tfayli, E. Ziemons
(5) Guidance for Industry : PAT – A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance, FDA, 2004
(6) Use of near infrared spectroscopy and multipoints measurements for quality control of pharmaceutical drug products Anal Bioanal Chem, 2016, 409, 683-691, 2017 Mathieu Boiret, Fabien Chauchard,
(7) Quality Considerations for Continuous Manufacturing – Guidance for Industry, FDA , 2019
(8) Continuous manufacturing: could 2021 be year of the first biologic approval ? Pharmaceutical Technology, dec 2020