Octobre 2023
La Vague n°79
Spécial Congrès 2023 : Annexe 1, Maitrise des procédés, environnement
Sommaire
- EU GMP Annex 1 (2022) : Aseptic Process Simulation (APS). De nouveaux ‘‘challenges’’ pour l’industrie pharmaceutique ?
- Introduction au procédé de remplissage des systèmes à double chambre (DCS)
- Mise en oeuvre des procédés de décontamination en industrie pharmaceutique
- Container Closure Requirements in the New EU GMP Annex 1 - Enabling Compliance with a Holistic Science-Based Approach
- Comment évaluer le risque pyrogène dans un process pharmaceutique injectable ? Outil d’aide à la décision
- Améliorer l’efficacité & la fiabilité de la qualification AVI : Détermination du nombre optimal de runs avec la méthode KNAPP
- Case Study: Effective Sterile Powder Transfer for Parenteral Drug Products
Comment évaluer le risque pyrogène dans un process pharmaceutique injectable ? Outil d’aide à la décision
En 2016, le chapitre 5.1.10 de la Pharmacopée Européenne “Recommandations pour la réalisation de l’essai des endotoxines bactériennes” a évolué, avec notamment l’ajout de la nécessité d’évaluer soigneusement le risque de présence de pyrogènes non endotoxiniques (PNE) dans la substance ou le produit à tester pour pouvoir utiliser l’essai des endotoxines bactériennes comme seul test de recherche de pyrogènes.

Au cours du congrès A3P 2017, avec l’océan en toile de fond, ce chapitre a animé la discussion de notre groupe d’amis microbiologistes issus de différentes entreprises. Au fur et à mesure, de nombreuses questions ont émergé, comme : “Quelles sont les différentes substances pyrogènes ? Comment les détecter ? Quels sont les avantages et inconvénients des différentes méthodes de détection ? Comment évaluer le risque de présence de pyrogènes pour un nouveau produit ?”
Cet article présente un exemple d’approche pouvant être utilisé dans le cas de produits injectables et mis à disposition des industriels, tout en respectant les recommandations réglementaires.
1. La grande famille des substances pyrogènes
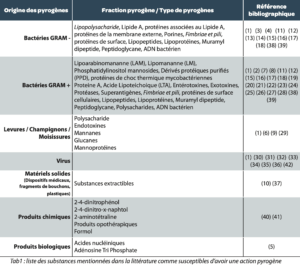
Une recherche bibliographique aussi exhaustive que possible, nous a permis d’établir la liste des substances suivantes mentionnées dans la littérature comme susceptibles d’avoir une action pyrogène (Voir Tab1).
Il est notable que de très nombreuses substances, de natures variées bien qu’essentiellement issues du vivant, sont reconnues comme ayant un effet pyrogène. Au sein de ces substances, les endotoxines issues des bactéries à Gram négatif sont connues et reconnues comme celles ayant l’activité pyrogène la plus élevée. Ceci explique probablement pourquoi un amalgame est parfois fait entre pyrogènes et endotoxines bactériennes.
2. Détection des pyrogènes : les avantages et inconvénients des différentes méthodes
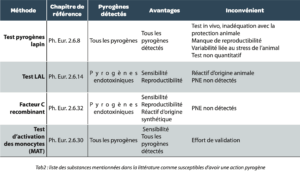
Différentes méthodes sont décrites dans la Pharmacopée Européenne pour la recherche des pyrogènes. Le tableau 2 présente les avantages et inconvénients de ces techniques. Ces dernières années la réglementation incite à la suppression progressive des tests pyrogènes chez le lapin, afin de s’affranchir des tests sur animaux.
Par ailleurs l’utilisation de réactifs recombinants est aussi introduite comme une alternative aux réactifs d’origine animale.
3. Mode d’évaluation du risque de présence de pyrogènes pour un nouveau produit
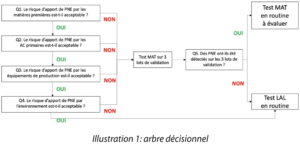
Notre réflexion et nos échanges animés et constructifs lors de sessions de travail en présentiel, à une époque où cela était la norme (2018), nous ont mené à définir les questions à se poser et les informations à compiler, pour standardiser et justifier le choix du type de test à appliquer. Le fruit de notre travail est synthétisé dans l’arbre décisionnel (illustration1).
Dans un but d’avoir une démarche à la fois structurée et reproductible nous avons défini les critères de réponse à chacune des questions essentielles. Les critères quantitatifs ne sont pas indiqués dans cet article, car il appartient à chaque industriel de les définir sur la base des risques inhérents au procédé évalué.
Dans un but d’avoir une démarche à la fois structurée et reproductible, nous avons défini les critères de réponse à chacune des questions essentielles. Les critères quantitatifs ne sont pas indiqués dans cet article, car il appartient à chaque industriel de les définir sur la base des risques inhérents au procédé évalué.
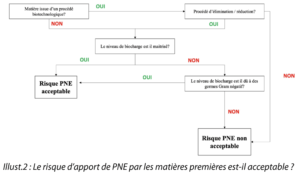
Question 1. Le risque d’apport de PNE par les matières premières est-il acceptable ?
L’une des sources importantes d’apport de PNE dans les matières étant liée à la présence de microorganismes autres que les bacilles à Gram négatif, une attention particulière est apportée à la maîtrise de la biocharge des matières entrantes dans le procédé de fabrication.
Question 2. Le risque d’apport de PNE par les AC primaires est-il acceptable ?
Cette question peut prendre en compte l’existence ou non d’un procédé validé de la réduction de la charge pyrogénique chez le fournisseur pendant le procédé de fabrication.(10;37) À noter que le lavage est un procédé de réduction de la biocharge qui peut également permettre de diminuer la charge pyrogène (validation spécifique à conduire).
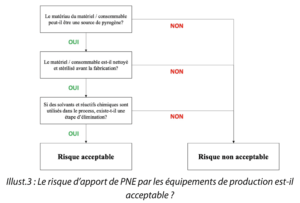
Question 3. Le risque d’apport de PNE par les équipements de production est-il acceptable ?
 |  |
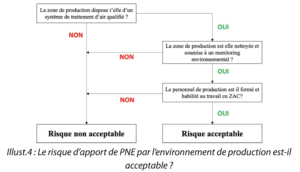
Question 4. Le risque d’apport de PNE par l’environnement de production est-il acceptable ?
Question 5. Détection de Pyrogènes en MAT sur les 3 lots de validation ?
En cas de réponse négative aux questions Q1 à Q4, le test MAT peut être réalisé sur les 3 lots de validation. Si des pyrogènes sont détectés, une investigation doit être conduite pour définir l’origine de la présence du / des pyrogènes. En fonction des résultats de l’investigation, la mise en place d’un test MAT en routine pourra être envisagée.
4. Conclusion
L’outil présenté est un exemple d’approche qui peut être utilisé pour répondre à la problématique d’éventuelles présences de pyrogènes dans les produits injectables. Cette réflexion est à intégrer dans le cadre du développement d’un nouveau produit. La récente parution de l’Annexe 1 ne fait qu’accentuer la nécessité de conduire des analyses de risques à tous les niveaux afin de réduire les risques de contamination microbiologique, particulaire et pyrogène. Ceci sera également renforcé avec la parution prochaine d’un nouveau chapitre au sein de la Pharmacopée Européenne, le chapitre 5.1.13 Pyrogénicité, en cours de revue pour commentaires.
Ce groupe de travail, constitué spontanément, montre encore à quel point tous les industriels sont confrontés à des problématiques similaires et que le travail en commun nous enrichit tous.
Partager l’article




Références
1 T. SANDLE (2015), Assessing Non-endotoxin Microbial Pyrogens in relation in pharmaceutical processing, Institute of Validation Network, March 2015.
2 K. W. BRUNSON AND DENNIS W. WATSON (1974), Pyrogenic Specificity of Streptococcal Exotoxins, Staphylococcal Enterotoxin, and Gram-Negative Endotoxin, Department of Microbiology, University of Minnesota Medical School, Minneapolis, Minnesota 55455, April 1974.
3 T. SANDLE (2012), Pyrogens, endotoxin and the LAL test : An introduction in relation to pharmaceutical processing, Global BioPharmaceutical Resources, Newsletter, May 2012.
4 P. GRANDICS (2000), Pyrogens in parenteral pharmaceuticals, Pharmaceutical Technology, April 2000 24(4):26-34.
5 R. CHARONNAT, P. LECHAT (1950), Recherches sur la nature des pyrogènes des solutés injectables, Mémoires présentés à l’Académie de Pharmacie-séance de mai 1950, Annales Pharmaceutiques Françaises, 1950 ; 8(3):171-81.
6 A. I. BRAUDE, J. MCCONNELL, and H. DOUGLAS (1960), Fever from pathogenic fungi. Journal of Clinical investigation, 1960, Aug; 39(8): 1266–1276.
7 I. GIMENES, C. CALDEIRA, O. A. FRANCA PRESGRAVE, W. CORREA DE MOURA, M. H. SIMOES VILLAS BOAS (2015) Assessment of pyrogenic response of lipoteichoic acid by monocyte activation test and rabbit pyrogen test, Regulatory Toxicology and Pharmacology. 73 (2015) 356-360.
8 A. R. HAUSER, D. l. STEVENS, E. l. KAPLAN and P. M. SCHLIEVERT (1991), Molecular Analysis of Pyrogenic Exotoxins from Streptococcus pyogenes Isolates Associated with Toxic Shock-Like Syndrome, Journal of Clinical Microbiology, Aug. 1991, p. 1562-1567 Vol. 29, No. 8.
9 S. NEYTCHEFF (1963), The pyrogenic effect of polysaccharides of C. albicans, C. tropicalis, C. pseudotropicalis and C. krusei , Zentralblatt für Bakteriologie. 1963 Sep; 190:132-8.
10 P. MICHON, A. LARCAN, J.-M. PICARD, C. KLING (1960), Les accidents perfusionnels de type pyrogénique: Contribution à l’étude de la toxicité éventuelle de substances plastiques utilisées dans les dispositifs de perfusion, Transfusion, 1960, Volume 3, Issue 2, Pages 131-144.
11 C.A. DINARELLO, R.J. ELIN, L. CHEDID, and S. M. Wolff (1978), The pyrogenicity of the synthetic adjuvant muramyl dipeptide and two structural analogues. Journal of Infectious Diseases, 1978, (198) 138, 760–767.
12 L. JOHANNSEN, J. WECKE, F. OBAL Jr and J.M. KRUEGER (1991), Macrophages produce somnogenic and pyrogenic muramyl peptides during digestion of staphylococci. American Journal of Physiology, 1991, 260, R126–R133.
13 D. FUMAROLA, I. MUNNO, C. MARCUCCIO and G. MIRAGLIOTTA (1986), Endotoxin-like activity associated with Lyme disease Borrelia, Zentralblatt für Bakteriologie, Mikrobiologie und Hygiene, 1986, 263, 142–145.
14 A. THOMSEN, H. LOPPNOW (1995). Cytokine production by mononuclear cells following stimulation with a peptide-containing, endotoxin-free Escherichia coli extract. Arzneimittelforschung, 1995 May;45(5):657-61.
15 R. J. ELIN and A. E. UTTER (1980), Positive Limulus amoebocyte lysate reactions with polyriboinosinic acid × polyribocytidylic acid. Journal of Clinical Microbiology, 1980, 12 (4), 502–505.
16 S.J. WONN and M.T. LIN (1993), Endogenous pyrogen formation by human blood monocytes stimulated by polyriboinosinic acid × polyribocytidylic acid. Experientia, 1993, Feb 15;49(2):157-9.
17 J.S. COWDERY, J.H. CHACE, A.K. YI, A.M. KRIEG (1996), Bacterial DNA induces NK cells to produce IFN-gamma in vivo and increases the toxicity of lipopolysaccharides. Journal of Immunoly, 1996, Jun 15;156(12):4570-5.
18 T. SPARWASSER, T. MIETHKE, G. LIPFORD, K. BORSCHERT, H. HÄCKER, K. HEEG, H. WAGNER (1997), Bacterial DNA causes septic shock, Nature, 1997 Mar 27;386(6623):336-337.
19 H. WEXLER and J.D. OPPENHEIM (1979), Isolation, characterization, and biological properties of an endotoxin-like material from the Gram-positive organism Listeria monocytogenes. Infection and Immunity, 1979, 23, 845–857.
20 J.G. VALLEJO, C.J. BAKER, M.S. EDWARDS (1996), Roles of the bacterial cell wall and capsule in induction of tumor necrosis factor alpha by type III group B streptococci. Infection and Immunity, 1996, 64(12):5042-5046.
21 O. TOIEN and J.B. MERCER (1996), Thermosensitivity is reduced during fever induced by Staphylococcus aureus cell walls in rabbits. Pflugers Archiv, European Journal of Physiology, 1996, 432, 66–74.
22 S.P. HACKETT, D.L. STEVENS (1992), Streptococcal toxic shock syndrome: synthesis of tumor necrosis factor and interleukin-1 by monocytes stimulated with pyrogenic exotoxin A and streptolysin O. The Journal of Infectious Diseases 1992 May;165(5):879-885.
23 D. FITZGERALD, I. PASTAN (1993), Pseudomonas exotoxin and recombinant immunotoxins derived from it, Annals of the New York Academy of Sciences, 1993, Jun 23;685:740-745.
24 S. BHAKDI, F. GRIMMINGER, N. SUTTORP, D. WALMRATH, W. SEEGER (1994), Proteinaceous bacterial toxins and pathogenesis of sepsis syndrome and septic shock: the unknown connection. Medical Microbiology and Immunology, Berlin, 1994, 183, 119–144 (published erratum appears in Medical Microbiology and Immunology, Berlin 183, 343–344).
25 S. HOULDSWORTH, P.W. ANDREW AND T.J. MITCHELL (1994), Pneumolysin stimulates production of tumor necrosis factor alpha and interleukin-1 beta by human mononuclear phagocytes. Infection and Immunity, 1994, 62, 1501–1503.
26 T. MURAI 1, Y. NAKAGAWA, Y. OGAWA (1996), Potentiation of lethal endotoxin shock by streptococcal pyrogenic exotoxin in rabbits: possible relevance of hyperreactivity of macrophages to endotoxin. FEMS Immunology and Medical Microbiology, 1996, 13(4), 269–272.
27 L.A. CARSON, L.A. BLAND, L.B. CUSICK, M.S. FAVERO, G.A. BOLAN, A.L. REINGOLD and R.C. GOOD (1988), Prevalence of nontuberculous mycobacteria in water supplies of hemodialysis centers. Applied Environmental Microbiology 1988, 54(12), 3122–3125.
28 G. RAWADI, S. ROMAN-ROMAN (1996), Mycoplasma membrane lipoproteins induced proinflammatory cytokines by a mechanism distinct from that of lipopolysaccharide. Infection and Immunity, 1996, 64(2):637-643.
29 V.S. Barwick, M.H. Wooten, J.F. Bradfield, R.D. Myers (1994), Fever of unknown origin: due to C. albicans or other fungi acting on the hypothalamus? Brain Research, 1994 Jan 28;635(1-2):1-8.
30 D.W. BARRY, R.E. MAYNER, H. D. HOCHSTEIN, R.C. DUNLAP, S.C. RASTOGI, J.E. HANNAH, R.J. BLACKBURN, J.L. SULLIVAN, R.J. GERETY (1976), Comparative trial of influenza vaccines. II. Adverse reactions in children and adults. American Journal of Epidemiology 1976, 104 (1), 47–59.
31 K.J. JAKEMAN, C.R. BIRD, R. THORPE, H. SMITH, C. SWEET (1991), Nature of the endogenous pyrogen (EP) induced by influenza viruses: lack of correlation between EP levels and content of the known pyrogenic cytokines, interleukin 1, interleukin 6 and tumour necrosis factor. Journal of General Virology, 1991, 72, 705–709.
32 S. BECKER, J. QUAY, J. SOUKUP (1991), Cytokine (tumor necrosis factor, IL-6, and IL-8) production by respiratory syncytial virus-infected human alveolar macrophages. Journal of Immunology 1991, 147(12):4307-4312.
33 A.M. ALLUWAIMI, H. SMITH, C. SWEET (1994), Role of surface glycoproteins in influenza virus pyrogenicity. Journal of General Virology 1994, 75, 2835–2840.
34 D.M. CHANG, M.F. SHAIO (1994), Production of interleukin-1 (IL-1) and IL-1 inhibitor by human monocytes exposed to dengue virus Journal of Infectious Diseases.1994, 170 (4), 811–817
35 M. KUROKAWA, M. IMAKITA, C.A. KUMEDA, K. SHIRAKI (1996), Cascade of fever production in mice infected with influenza virus. Journal of Medical Virology 1996, 50 (2), 152–158.
36 G.E. PRICE, R.J. FENTON, H. SMITH, C. SWEET (1997), Are known pyrogenic cytokines responsible for fever in influenza? Journal of Medical Virology 1997, 52 (3), 336–340.
37 K.M. MILLER, J.M. ANDERSON (1988), Human monocyte/macrophage activation and interleukin 1 generation by biomedical polymers. Journal of Biomedical Material Research 1988, 22 (8), 713–731.
38 B. HENDERSON, M. WILSON (1996), Cytokine induction by bacteria: beyond lipopolysaccharide, Cytokine 1996, 8 (1)269-282.
39 M. LAUDE-SHARP, N. HAEFFNER-CAVAILLON, M. CAROFF, F. LANTREIBECQ, C. PUSINERI, M.D. KAZATCHKINE (1990), Dissociation between the interleukin 1-inducing capacity and Limulus reactivity of lipopolysaccharides from gram-negative bacteria. Cytokine. 1990, 2(4):253-258.
40 R. CHARONNAT, P. LECHAT (1951), Research on the nature of pyrogens in injection solutions. II. Attempts of quantitative determination of pyrogenic substances; pyrogenic index Annales Pharmaceutiques Françaises. 1951, 9(1):22-30.
41 L. Dubreuil et Ch. Romond (1981), Le pyrogène bactérien. Bulletin de la société de pharmacie de Lille 1981, 1 :11-18
42 J.H. GONG, H. SPRENGER, F. HINDER, A. BENDER, A. SCHMIDT, S. HORCH, M. NAIN, D. GEMSA (1991), Influenza A virus infection of macrophages: enhanced tumor necrosis factor alpha (TNF-alpha) gene expression and lipopolysaccharide- triggered TNF-alpha release. Journal of Immunology, 1991, 147 (10), 3507–3513.