Sommaire
- TITRE ARTICLE 1
- Méthode alternative d’identification. Exemple d’une implémentation d’un système Maldi Tof au laboratoire de contrôle.
- Implantation d’une méthode microbiologique alternative et polyvalente au laboratoire. Exemple du BACTALERT 3D®
- From Variable Operator Numeration To The Standardized 3P® Station Automated Colony Counting On Environmental Monitoring Culture Media Plate
- Analyse de la charge microbienne en temps réel pour prévenir les risques de contamination et mieux contrôler les procédés.
- ISO 22519 PW/WFI production systems standard: Quality aspects.
- Eau pour préparations injectables en vrac (productions, coûts). Étude de cas axée sur la qualité microbiologique.
- Coming to basics on rouging.
- Winning combination: Reducing particles in RTU packaging by aligning lid material, adhesive and sealing parameters in a holistic approach.
Eau pour préparations injectables en vrac (productions, coûts). Étude de cas axée sur la qualité microbiologique.
Le premier objectif est de permettre à tous les utilisateurs d’eau pour préparations injectables vrac (EPPIV) de choisir en comparant les technologies les plus appropriées pour produire de l’EPPIV en conformité avec les Pharmacopées et les Bonnes Pratiques de Fabrication Européenne et les Good Manufacturing Practice (GMP) Américaine.
Le second objectif est de vérifier qu’il est possible de réaliser des économies importantes de coûts en produisant du l’EPPIV via une production membranaire. Puis en dernier, une présentation d’une étude de cas concernant l’aspect microbiologique d’une production et distribution d’EPPIV (par une production d’EPPIV membranaire).

1. Producteurs et coûts de l’eau pour préparations injectables en vrac
a) Les eaux à usage pharmaceutique (EUP)
Les Eaux à Usage Pharmaceutique (EUP) sont considérées comme essentielles dans le processus de fabrication du médicament et elles existent sous deux formes différentes en vrac.
L’eau purifiée en vrac (EPV) et l’eau pour préparations injectables en vrac (EPPIV) sont toutes les deux décrites en détail dans toutes les Pharmacopées, notamment les pharmacopées américaine, européenne, japonaise, chinoise, brésilienne, russe, indienne….
b) Production de médicaments
Pour la production des médicaments liquides, solides ou injectables, l’industrie pharmaceutique utilise ces deux qualités d’eaux : EPV et EPPIV. Différentes technologies de purification de l’eau potable (bonne à la consommation humaine) sont disponibles pour produire ces deux qualités d’eaux à usage pharmaceutique.
Les performances de chaque technologie sont liées à la qualité de l’eau potable d’alimentation ou rendue potable et à la qualité de l’eau à usage pharmaceutique demandée, au coût d’investissement, au coût de fonctionnement, à sa fiabilité, à sa robustesse, à sa durabilité et à l’élimination ou la diminution des risques liés à la technologie choisie.
c) Pharmacopées Européenne et Américaine
La Pharmacopée Américaine permet la production d’EPPIV par distillation ou par des moyens équivalents ou supérieurs à la distillation depuis plus de 30 ans. Ces moyens équivalents ou supérieurs à la distillation sont tout de même peu répandus sur le marché nord- américain et nombre d’entreprises pharmaceutiques opérant aux USA privilégient l’usage de distillateurs.
Jusqu’à récemment, la Pharmacopée Européenne exigeait l’utilisation de la distillation. Historiquement, la distillation a été l’unique technologie utilisée en Europe pour la production d’EPPIV. La Pharmacopée Européenne a révisé sa monographie pour proposer un “procédé de purification équivalent à la distillation, telle que l’osmose inverse, associé à des techniques appropriées”.
d) Harmonisation
La Pharmacopée Européenne a modifié la monographie de l’EPPIV pour harmoniser avec la Pharmacopée Américaine.
e) Annexe 1
Dans le texte de l’Annexe 1, rédigé par l’EMA, un paragraphe concernant l’EPPIV a été intégré et à ce jour l’annexe 1 révisée n’est toujours pas approuvée.
Un des risques perçus par l’EMA est la gestion d’un biofilm sur les membranes d’osmose inverse. L’EMA avait même présenté lors d’une réunion à l’EDQM (Direction Européenne de la Qualité du Médicament et des soins de santé située à Strasbourg) des photographies de membranes d’osmose inverse contaminées par un biofilm et demandé comment résoudre ce problème.
Suite à la révision de la monographie de la Pharmacopée Européenne, l’EMA a publié “Questions et réponses sur la production d’eau pour préparations injectables en vrac” par des méthodes autres que la distillation. L’EMA a fait part une nouvelle fois de sa préoccupation liée à la qualité microbiologique de l’EPPIV produite et des contrôles analytiques mis en place pour minimiser les risques de contamination de la production membranaire d’EPPIV.
Pour rappel, l’efficacité des distillateurs à multiples effets (MES) ou à thermo compression (TCS) de la vapeur ne sont plus à démontrer pour produire de l’EPPIV quel que soit son mode de fonctionnement.
f) Productions d’EPPIV
Vous trouverez ci-dessous une brève analyse des coûts de quatre producteurs d’EPPIV choisis en fonction des usages et des Pharmacopées Européenne et Américaine :
• Distillateur multi-effets (MES)/boucle chaude ou boucle froide ozonée.
• Système membranaire/boucle froide ozonée ou boucle chaude.
• Distillateur par thermocompression de la vapeur (TCS) boucle chaude ou froide.
• Ultrafiltration (UF) ou osmose inverse (RO)/Distillateur par thermocompression de la vapeur (TCS) boucle chaude ou froide.
Chaque technologie proposée est commentée et est recommandée ou pas. La fiabilité, la robustesse et la durabilité bien qu’étant des facteurs importants, ne sont pas considérées ici mais seront à prendre en compte bien évidemment dans vos études comparatives.
Les coûts d’investissement incluent la mise en route, la formation, l’exécution des protocoles de qualification d’installation (QI)/de qualification opérationnelle QO/hors qualification de performance (QP), la qualification ou validation mais hors transport et installation (ne connaissant ni le lieu et ni le local d’implantation).
Les coûts de fonctionnement pour chacun des quatre producteurs incluent l’eau potable, les énergies, la vapeur industrielle, l’électricité, l’eau de refroidissement (les utilités), l’air comprimé, les eaux usées, la maintenance (pièces de rechange, consommables et main d’œuvre inclus).
Chaque utilisateur réalise sa QP et ensuite son programme d’analyses en routine, ce qui ne permet pas de prendre en considération le coût analytique.
Fonctionnement
Les coûts de chacune des quatre productions sont évalués à partir d’un débit de production de 1,5 m3/h, son fonctionnement est de 16 h par jour, de 7 jours / 7 et de 50 semaines / an soit une production d’EPPIV de (1,5x16x7x50 =) 8400 m3/ an.
Tous les producteurs sont alimentés avec la même qualité d’eau potable. L’eau potable ou bonne à la consommation humaine d’alimentation doit répondre aux normes de potabilité. Dans tous les cas, une analyse spécifique et complète de l’eau potable d’alimentation doit être fournie par l’utilisateur pour finaliser la conception du producteur et du prétraitement.
A chacun de déterminer ce qui est ou non acceptable en réalisant une analyse de risques :
• Contamination probable due à un biofilm présent dans la production.
• Bactéries présentes dans le biofilm dont certaines produisent des endotoxines non détectables à l’aide du test LAL, probablement issues de Sphingomonas paucimobilis qui est l’exception car non détectés par le test LAL car sans LPS.
• L’ozone est issu d’une réaction chimique interne sans ajout externe de produits chimiques et une concentration comprise entre 0 et 5 ppb reste présente dans l’EPPIV produite (O3 est un élément provenant d’une réaction chimique !),
• Le coût d’une non-conformité.
• Le coût analytique renforcé par rapport à un distillateur.
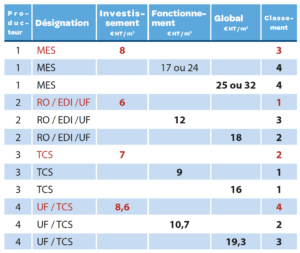
Synthèse des coûts (Amortissement sur 10 ans)
Les meilleurs coûts de fonctionnement sont réalisés avec les producteur TCS ou UF (RO) / TCS, cette technologie de production d’EPPIV est très robuste et facile à maintenir.
Les coûts de fonctionnement de production membranaire d’EPPIV est en troisième position. Bien évidemment la production d’EPPIV par MES a les coûts de fonctionnement les plus élevés.
Concernant les coûts globaux, le constat est que la distillation par TCS est en première position puis la production membranaire RO / EDI / UF en 2nde position. Si nous parlons de robustesse et de fiabilité, nous pouvons classer les producteurs de la manière suivante : 1er MES ou 1er TCS, 3ème UF (RO) / TCS, 4ème RO / EDI / UF.
2. Aspect microbiologique et retour d’expérience
L’idée de ce chapitre n’est pas tant d’apprécier ces technologies quant à leurs capacités à produire de l’EPPIV répondant aux différentes monographies d’un point de vue microbiologique car elles le sont toutes mais d’illustrer les risques potentiels.
Il est probable qu’un distillateur faisant l’objet d’une maintenance préventive non adaptée produira quand même une EPPIV de qualité et ce quelle que soit la qualité de l’eau déminéralisée d’alimentation. En revanche, il est certain qu’un système membranaire mal entretenu ne pourra pas produire la qualité attendue. De même, nul besoin de préciser qu’une boucle de distribution froide de l’EPPIV nécessitera un niveau de maitrise très élevé pour fournir la même qualité qu’une boucle de distribution chaude. En effet, une EPPIV à une température supérieure à 65°C en chaque point de la boucle de distribution et donc de surcroit à 70°C ou 80°C ou plus offre une sécurité microbiologique très appréciable quand bien même quelques petits péchés de design auraient été commis. Annexe 1: “7.7 Water treatment plants and distribution systems should be designed, constructed and maintained to minimize the risk of microbial contamination and proliferation so as to ensure a reliable source of water of an appropriate quality. Water produced should comply with the current monograph of the relevant Pharmacopeia.”
Prenons le retour d’expérience ci-dessous qui a eu lieu il y a deux ans dans un pays d’Asie et qui concerne une contamination massive d’une installation de production et de distribution d’EPPIV froide.
L’eau de ville est adoucie, traitée sur charbon actif puis micro filtrée puis alimente une double osmose inverse avant d’être distribuée à froid. Après un an d’exploitation, cette récente unité de production et de distribution d’EPPIV n’offre pas les tendances microbiologiques attendues :
• Contaminations fréquentes par Pseudomonas spp (identifications biochimiques),
- Aucune contamination détectée de l’unité de production,
- Aucune détection d’endotoxines par test LAL.
Quelles sont les actions immédiatement prises ?
Le site concerné ouvre une déviation et commence une investigation. Comme action corrective, une désinfection thermique de la boucle de distribution avec de l’eau surchauffée est lancée. Le laboratoire arrive rapidement à la conclusion que cette contamination est le résultat de mauvaises pratiques de prélèvement de l’EPPIV.
Quelques mois plus tard le microbiologiste avouera qu’il avait un doute car il s’était attendu à trouver également des germes de la peau des préleveurs ou des bacilles sporulants en plus des Pseudomonas si la cause n’avait été liée qu’aux pratiques de prélèvement. De fait, et au titre des actions dites préventives, les techniciens du contrôle qualité, responsables des prélèvements d’EPPIV, ont fait l’objet d’une nouvelle formation.
Pour quel résultat ?
Cela n’a absolument rien changé. Les prélèvements étaient de plus en plus contaminés. Pire, la boucle se contaminait à nouveau de plus en plus rapidement après les désinfections thermiques à l’eau surchauffée au point de justifier une désinfection thermique chaque week-end là ou une désinfection thermique annuelle préventive est généralement suffisante.
Si les prélèvements ne sont pas la cause des contaminations alors quel est le problème ? Le site a évolué et a logiquement considéré que la boucle de distribution à froid d’EPPIV était finalement contaminée en son sein par un biofilm. C’est certainement assez logique compte tenu du fait que Pseudomonas est un classique du phénomène. Un biofilm dans les boucles de distribution d’eaux à usage pharmaceutique est une stratégie d’adaptation courante pour la survie de nombreux micro-organismes. Lamatricedu biofilm est composée de plusieurs éléments chimiques. La température appliquée et appropriée est la meilleure prévention d’un biofilm dans une boucle de distribution d’eaux à usage pharmaceutique. Mais une fois contaminée, un traitement thermique à lui seul tuera probablement tous les contaminants, ce qui est un bon début, mais a un impact très limité sur l’élimination de la matrice elle-même.
Si un biofilm n’est pas correctement éliminé, les débris organiques et cellulaires résiduels peuvent favoriser la croissance de nouvelles bactéries ubiquitaires et la colonisation par un nouveau biofilm : les eaux pharmaceutiques, y compris l’EPPIV, ne sont en réalité pas stériles et peuvent ensemencer de nouvelles bactéries véhiculées par l’eau…
Le risque est de finalement déclencher un cercle vicieux : plus le traitement thermique est fréquent, plus le biofilm revient vite et plus fort si la matrice cellulaire n’est pas retirée. Le retrait de la matrice est donc une étape nécessaire dans tout processus de restauration et un nettoyage en profondeur de la tuyauterie est un élément nécessaire du contrôle de la contamination. Pour éliminer efficacement les biofilms, il est généralement nécessaire tout d’abord, de procéder à un traitement alcalin (par exemple NaOH, KOH) pour hydrolyser le biofilm et aider à le décrocher de la surface de la tuyauterie ; puis, un traitement thermique à l’aide d’eau surchauffée par exemple peut être efficace APRÈS l’élimination initiale en raison de la pénétration de la chaleur dans les crevasses où le biofilm pourrait résider.
Le site a finalement fait l’acquisition d’un système d’ozonation pour désinfecter chimiquement la boucle de distribution d’EPPIV toutes les nuits. Cette action pourrait être une très belle action préventive si le biofilm ou la température de distribution de l’EPPIV était la cause racine. Mais il n’en était rien ! Pire, l’ozone a eu un effet paradoxal en masquant la contamination initiale qui finalement n’était pas dans la boucle de distribution mais dans le producteur d’EPPIV. Dit autrement, la contamination détectée dans la boucle n’était finalement que la conséquence d’une contamination plus en amont.
Quelle était alors la vraie cause racine ?
En première intention, et après une progression centimètre par centimètre le long des équipements de cette installation, il a fallu considérer que la cause racine était finalement la maintenance préventive du filtre à charbon actif. Au lieu d’être noir, le charbon était vert-bleu. Ce charbon actif a pour objet de retirer le chlore dans sa totalité de l’eau de ville autrement c’est un poison pour les membranes d’osmose inverse. C’est également un excellent support pour les biofilms. Il était remplacé une fois par an.
Mais pourquoi comparer avec l’Europe ?
Tout le monde sait que pour trouver une cause racine il est utile de se poser un certain nombre de fois pourquoi ? pourquoi ? pourquoi ?
Cinq fois habituellement pour conserver la tradition. De fait, pourquoi ce filtre à charbon actif était remplacé une seule fois par an dans ce contexte ? Parce que l’installation avait été construite à l’identique, design ET procédures d’utilisation, d’une première installation construite en Europe avec de l’eau potable en début de procédé de production. La vraie cause racine, celle dite finale, était culturelle. Le site européen a souhaité que le site asiatique exploite une installation de production d’EPPIV selon des standards propres à l’Europe en surestimant sans doute la capacité d’un système membranaire à retirer suffisamment les micro-organismes à partir d’eau de ville qui n’est pas encore au standard européen.
Quelle est la réponse préventive la plus appropriée ?
En première intention, la bonne réponse préventive était pour ainsi dire une meilleure adaptation de la fréquence de changement du filtre à charbon actif pour tenir compte de la réalité microbiologique de l’eau de “Ville ” et de la non présence de chlore. C’est effectivement ce qui a été réalisé. En seconde intention, peut-être aurait-il fallu tenir compte également de la cause la plus en amont et finalement d’une mauvaise adéquation d’un système de production d’EPPIV membranaire pour ce contexte asiatique. Sans doute qu’une distillation aurait été beaucoup plus indépendante de la qualité de l’eau initiale et donc plus adaptée à ce contexte.
Retour d’expérience sur les risques associés à une boucle de distribution.
Le présent retour porte sur la même installation décrite et sur le même épisode de contamination. Il s’intéresse à la présence d’endotoxines et donc davantage aux conséquences d’une contamination microbiologique d’une boucle d’EPPIV. Ce retour n’est finalement pas directement lié au fait que la boucle de distribution est froide mais en est tout de même une résultante. En effet, la boucle aurait été chaude que le risque de biofilm aurait été réduit…
Cette introduction peut être trompeuse. Elle peut laisser penser que le site a constaté une présence excessive d’endotoxines du fait de la contamination microbienne de la boucle d’EPPIV. Et bien, ce n’est finalement pas le cas. C’est en fait l’inverse ! Malgré les contaminations récurrentes par Pseudomonas (identification biochimique) aucun signal faible en endotoxines n’a pu être détecté. Puisque tous les tests LAL étaient inférieurs à la limite de détection lors des épisodes de contamination par Pseudomonas (identification biochimique), bacille à Gram négatif, l’EPPIV était donc conformes aux monographies usuelles, y compris US, EU et JP.
Cette non détection a été vue comme un fait rassurant dans le cadre de l’analyse d’impact initialement réalisée par le site, en aucun cas comme un faux négatif. Quelques semaines après le début de l’épisode de contamination, le contaminant s’est finalement révélé être un Sphingomonas paucimobilis par identification génotypique (PCR) au lieu d’un Pseudomonas spp par identification biochimique.
Cela change beaucoup de choses. Il faut en cas de dénombrement s’assurer d’avoir une méthode d’identification appropriée et fiable. L’Annexe 1 dit clairement que les méthodes utilisées doivent être fiables et scientifiquement à jour. Le test LAL détecte les LPS des bactéries Gram négatif où le Sphingomonas paucimobilis est la seule exception de Gram négatif sans LPS. Donc il est normal que le LAL ne le détecte pas.
Les résultats LAL NE PEUVENT PAS être considérés car le test LAL n’est PAS pertinent et entraînera un FAUX NÉGATIF…La présence et l’adaptation de Sphingomonas spp dans de l’EPPIV, a déjà été largement documentée. Le test LAL consiste à détecter ou à quantifier les endotoxines de bactéries à Gram négatif à l’aide du lysat d’amebocytes de Limule ou “crabe fer à cheval”.
Le test LAL réagit avec les Lipo Poly Saccharide (LPS), qui sont un composant membranaire des bactéries à Gram négatif. Mais voilà, Sphingomonas spp, contrairement aux autres bacilles à Gram négatif, ne contient pas de LPS dans sa capsule externe mais contient des Glyco Sphingo Lipid (GSL). Par conséquent, et malgré la présence de GSL dans l’EPPIV vrac, le test LAL ne peut pas réagir et ne peut donc pas détecter ce type d’endotoxines.
Dit autrement et en fonction du contexte un résultat du type <0,25 UI/mL dans un certificat d’analyse d’EPPIV ne signifie pas nécessairement que l’EPPIV est conforme !!
3. Conclusion
Productions et distributions d’EPPIV
Concernant la production membranaire d’EPPIV Une défaillance de l’une des trois technologies (RO/EDI (ou RO) /UF) a un impact négatif sur la qualité de l’EPPIV produite. Les coûts de la maintenance d’une production membranaire sont supérieurs à des distillateurs de type un MES et TCS car la maintenance est réduite (pas de membranes RO, pas de membrane EDI, pas d’UF et également aucun test d’intégrité réalisé sur les UF). Les exigences analytiques sont supérieures pour une production membranaire car le risque de contamination bactérienne est plus important que pour un distillateur (aucun risque de présence de biofilm).
La qualité de l’EPPIV produite par distillation est indépendante de la qualité de l’eau potable d’alimentation, tandis que la qualité de l’EPPIV produite à l’aide d’une production membranaire est directement influencée par la qualité de l’eau potable.
La distillation par thermo compression de vapeur alimentée en eau adoucie et dé- chlorée est le moyen le plus économe en énergie pour produire de l’EPPIV.
Le TCS a un rendement supérieur aux autres technologies. L’évaporation de l’eau adoucie et dé-chlorée alimentant le distillateur TCS se fait à une température de 135°C. L’évaporation de l’eau déminéralisée alimentant le distillateur MES se fait à une température de 165°C. Les distillateurs à MES sont donc plus sensibles à l’entartrage et à la corrosion. Le distillateur TCS n’est pas soumis à un contrôle tous les 10 ans (équipement sous vide).
Microbiologie
Les tests de détection des endotoxines utilisant les réactifs LAL (Limulus Amebocyte Lysate) ou rFC (recombinant FacteurC) détectent la présence de LPS (Lipopolysaccharide) partie interne de la membrane des bactéries Gram négatif.
Dans le cas cité, le Sphingomonas paucimobilis identifié tardivement par technique PCR et bien qu’étant Gram négatif, n’a pas de LPS dans sa membrane et n’est donc pas détectable par les tests LAL ou rFC. Dans ce cas bien particulier, les différents tests de routine réalisés pour analyser la qualité de l’EPPIV prennent toutes leurs importances. Bien que le taux d’endotoxines soit inférieur à la limite de 0,25 EU/ml, qu’en est-il de la recherche de germes totaux, le Sphingomonas ne présentant pas d’exigences particulières de culture a été détecté mais mal identifié et a conduit à de mauvaises investigations sachant qu’il est possible d’avoir une absence de LPS malgré une présence de germes. Le test BET est bien complémentaire au Bioburden. D’autres tests pourraient permettre la détection de germes Gram- sans endotoxines, comme le test lapin (Rabbit Pyrogen Test-RPT) ou le test MAT (Monocytes Activation Test), ces tests permettent la détection de toutes substances pyrogènes dont celles non détectées par les tests endotoxines. Le Shingomonas devrait être détecté par cette méthode. Qu’aurait apporté une réponse positive ? Est-ce que l’identification par PCR n’aurait pas attiré l’attention plus rapidement ? Plus spécifique, des laboratoires spécialisés peuvent mettre en évidence le GSL (Glycosphingophospolipides) par technique ELISA utilisant des anticorps spécifiques.
D’un point de vue santé publique, des cas de bactériémies à Sphingomonas paucimobilis (Sp) avec hyperthermie suites à des perfusions d’immunoglobulines ont été rapportés. Les hémocultures positives à Sphingomonas Sp ont permis le diagnostic de bactériémie sur cathéter. L’évolution a été favorable sous antibiothérapie et retrait du matériel mis en cause. Sphingomonas paucimobilis est un bacille Gram-négatif non fermentant (BGNF), aérobie, pigmenté, possiblement pathogène pour l’homme notamment en présence de matériel étranger ou d’immunodépression. Germe environnemental, de la famille des Sphingomonadaceae, il est cependant beaucoup plus facile à traiter que les autres BGNF. Les cas décrits dans la littérature sont souvent bénins et associés à des dispositifs invasifs. La faible mortalité est probablement due à l’absence de lipopolysaccharides typiques et d’endotoxine. L’antibiothérapie doit être associée au retrait des dispositifs invasifs.
Partager l’article

Olivier CHANCEL – Boehringer-Ingelheim
Pharmacien, diplômé en production et contrôle qualité du médicament ainsiqu’engestiondesentreprises. Actuellementexpertenstérilitéet assurance de la stérilité et auditeur qualité senior. A travaillé dans ou avec l’industrie pharmaceutique pendant 20 ans : recherche et développement pharmaceutique, assurance qualité, contrôle qualité, gestion de projet et production de formes galéniques solides et injectables. A publié des articles concernant les activités en salle blanche ou les pratiques aseptiques
Olivier.chancel@boehringer-ingelheim.com
Sylvie GENOUX AUBERT – Biomérieux
Endotoxin Business Manager chez bioMerieux depuis 2017, Sylvie participe au développement de la nouvelle gamme ENDONEXT utilisant le facteur C recombinant pour la détection des Endotoxines. Précédemment, elle a travaillé quelques années sur l’implémentation d’un automate de microbiologie et plus de 20 ans dans le domaine des endotoxines en tant que Sales Manager en charge des ventes, du support et de la formation des clients pharma.
sylvie.genoux@biomerieux.com

Robert NERI – Consultant
Expert eaux à usage pharmaceutique et eau de process.
robertneri55@gmail.com
Références
• EMA-ICH Q7A (API GMP)
• EU-GMP annex 15: Qualification & Validation
• EMA-CPMP/QWP/158/01 (Note for Guidance on Pharma. Water Quality) • European Pharmacopoeia-9.3th Ed. (Water Monograph & Tests)
• USP 41 (Water Monograph & Tests)
• WHO Annex 3- Water for Pharmaceutical Use (WPU)
WHO GMP Annex 2: Water for Pharmaceutical Use (WPU)
• Farmacopeia Brasileira, 5° Ed. November 2010
• Pharmacopoeia of the Russian Federation- Parts 1 &2 (2010)
• FDA-Guide to Inspection of High Purity Water Systems-1993
• PIC/S PI009-3 Pharmaceutical Inspection Convention &Pharmaceutical Inspection CO-operation Scheme, Aide memoire: Inspection of utilities
• ICH Q9_Quality Risk Management
• Pharmacopoeia: Chine / Japon / Canada …
• PDA-Technical Report No4 “Design Concepts for the Validation of a Water for Injection System”
• ASME BPE 2016 Bioprocessing Equipment
• ISPE Baseline Pharmaceutical Engineering Guide_Vol.4: “Water and Steam Systems” December 2011_Second Edition
• ISPE Approaches to Commissioning and Qualifications of Pharmaceutical Water and Steam Systems (2014)
• Water and Steam Systems 2019 – Volume 4
• GAMP5_A Risk-based approach to Complaint Gxp Computerized Systems (2008)
• ISPE GAMP- A Risk-based approach to Complaint Gxp Computerized Systems (2nd Ed. 2011)
• ISO 22519 First edition 2019-06 Purified water and water for injection pretreatment and production systems
• MECO www.meco.com
• Stilmas www.stilmas.com
• DOC www.docvalidation.it
• G-06 Bactériémies à Sphingomonas paucimobilis et perfusion d’immunoglobuline intraveineuse. À propos de 3 cas ; 03/07/08. Doi : 10.1016/S0399-077X(08)73125-1. J.P.Lanoix,A.Borel,V.Salle,A.Smail,D. Thomas, J.L. Schmit. CHU Amiens, 80054 Amiens, France
• https://www.americanpharmaceuticalreview.com/Featured- Articles/557459-Endotoxin-Testing-as-a-Detection-Method-for-Bacterial- Biofilms
Glossaire
OMS Organisation Mondiale de la Santé WHO World Health Organisation
GMP Good Manufacturing Practice
BPF Bonnes Pratiques de Fabrications
ICH International Conference on Harmonisation EPA Environmental Protection Agence
EPA Environmental Protection Agency
FDA Food and Drug Administration
EMA Agence Européenne des Médicaments
ANSM Agence Nationale de Sécurité du Médicament et des produits de santé
EPV Eau Purifiée Vrac
EPPIV Eau Pour Préparations Injectables Vrac
PS Pure Steam
VP Vapeur Pure
WPU Water For Pharmaceutical Use EUP Eaux à Usage Pharmaceutique RO Reverse Osmosis (Osmose Inverse) EDI Electro-Dé-Ionisation