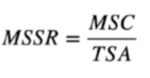Sommaire
- Comment accélérer la libération grâce aux CAPA ?
- La libération pilotée et maîtrisée par le management Visuel
- Dossier de Lot Electronique : les opportunités et les pièges à éviter
- Le défi de la digitalisation des enregistrements de production
- AQU@Sense MB: A technological evaluation for « on-line » pharmaceutical water analysis
- Individual closed isolators for cell therapy
- Evaluation of a Quaternary Ammonium Ready To Use (RTU) Disinfectant and Hydrogen Peroxide/Peracetic Ready To Use (RTU) Combination Sanitization Regimen for Cleanroom Start-Up
- Introduction à la norme ASTM E3263-20 "Standard Practice For Qualification Of Visual Inspection of Pharmaceutical Manufacturing Equipment And Medical Devices For Residues" (Standard pour la qualification de l'inspection visuelle des équipements de fabrication pharmaceutique et des dispositifs médicaux pour les résidus)
Introduction à la norme ASTM E3263-20 "Standard Practice For Qualification Of Visual Inspection of Pharmaceutical Manufacturing Equipment And Medical Devices For Residues" (Standard pour la qualification de l'inspection visuelle des équipements de fabrication pharmaceutique et des dispositifs médicaux pour les résidus)
L’inspection visuelle est largement utilisée depuis de nombreuses années après un nettoyage des équipements par les industries pharmaceutiques, les biotechnologies et les fabricants de dispositifs médicaux, pour libérer les équipements et dispositifs. Cependant, l’inspection visuelle n’a jamais été démontrée comme une méthode effcace, fi able ou sûre à utiliser.

Récemment, l’Agence européenne des médicaments (EMA) a publié un document de questions- réponses à sa directive sur la détermination des limites d’exposition basées sur la santé, dans lequel elle décrit les critères à respecter pour que l’inspection visuelle soit acceptable par l’EMA pour la libération des équipements de fabrication. Plusieurs articles et guidances ont été nécessaires pour guider ces industries sur la manière de répondre à ces critères et démontrer que les opérateurs réalisant l’inspection des équipements sont capables et qualifiés pour évaluer avec précision l’absence ou la présence de résidus sur les équipements de fabrication ou les dispositifs médicaux.
Cet article partage l’élaboration et la publication d’une nouvelle norme ASTM International (American Society for Testing and Materials) sur la qualification de l’inspection visuelle après un processus de nettoyage.
Histoire et Perspectives réglementaires de l’inspection visuelle
Depuis 1979, la réglementation américaine exige “l’inspection des équipements de fabrication immédiatement avant leur utilisation”. Bien que cette réglementation ne spécifie pas que l’inspection devait être “visuelle”, en pratique, les industriels l’ont appliquée ainsi et les autorités réglementaires en sont venues à considérer cette “inspection” comme une exigence « d’inspection visuelle”. Mais pendant tout cette période, seules quelques études sur l’inspection visuelle ont été réalisées avec des résultats variables”.
En 1993, un article fameux a été publié qui mentionnait que des études par dépôt sur coupon indiquaient que de nombreux composés étaient visibles à environ 100 μg/4 in2 soit 4 μg/cm2. Un autre article, publié en 1994, affirmait que les résidus pouvaient être vus jusqu’à 1 μg/cm2 en utilisant une source de lumière supplémentaire. Un autre article publié en 2000 affirmait que les résidus de plusieurs composés étaient visibles jusqu’à environ 0,4 μg/cm2. Une série d’études portant sur plusieurs composés différents a établi une fourchette allant de 0,4 à >10 μg/cm2. Trois études utilisant une technique de dépôt différente, répartissant le résidu uniformément sur la surface ont trouvé des limites de détection pour un résidu à des niveaux de 3, 5 et 7 μg/ cm2. Ces limites de détection ont été calculées selon une approche ICH Q2 et se sont avérées être influencées par plusieurs facteurs, dont la formation des opérateurs. En 2010, Ovais Mohammad a proposé d’utiliser une approche statistique -par régression logique- pour ces études coupons afin de calculer plus précisément la limite de résidus visibles.
Bien qu’aucune étude et analyse approfondie de la capacité de l’inspection visuelle à identifier la présence de résidus n’ait été réalisée à ce jour, les autorités de réglementation semblent désormais plus ouvertes à son utilisation. La mise à jour en 2015, de l’annexe 15 des GMPs Européenne stipule désormais “qu’il n’est généralement pas acceptable que ce critère seul soit utilisé*”, ce qui indique que l’inspection visuelle pourrait être utilisée seule pour la validation du nettoyage dans certaines circonstances. Conscient de l’importance de position, le guide ASTM E3106 a fourni les orientations suivantes pour appuyer cette déclaration de l’annexe 15 :
“L’utlisation de l’inspection visuelle seule pour la validation peut être acceptable seulement lorsque le risque est coté à Faible et que 100% de la surface de l’équipement peut être inspecté dans des conditions appropriées.”
(*Le texte exact est : « L’utilisation de ce critère à lui seul n’est généralement pas acceptable », annexe 15_10.2).
Allant encore plus loin dans cette direction, le programme de coopération en matière d’inspection pharmaceutique (PIC/S) stipule désormais que “…des études coupons devraient déterminer la concentration à laquelle la plupart des ingrédients actifs sont visibles”, ce qui indique que ces Agences de Santé s’attendent à voir l’inspection visuelle et son seuil de détection visuel utilisée plus fréquemment et avec des exigences pour son utilisation.
En avril 2018, l’EMA a publié une mise à jour de son projet de Q&A sur la directive relative à la fixation des limites Health Based Exposure Limits (HBELs). Dans cette version finale, deux nouvelles informations sont apparues (#7 et #8) directement applicables à l’utilisation de l’inspection visuelle.
Ces questions-réponses sont les suivantes :
Q7. Les tests analytiques sont-ils requis lors du changement de produit, sur les équipements dans les installations partagées, après réalisation de la validation du nettoyage ?
R : Les tests analytiques doivent être effectués à chaque changement de produit, à moins que le contraire ne soit justifié par un processus de gestion du risque qualité (QRM) solide et documenté. Le processus QRM doit prendre en compte, au minimum, chacun des éléments suivants :
- La répétabilité du processus de nettoyage (le nettoyage manuel est généralement moins répétable que le nettoyage automatisé) ;
- Le risque posé par le produit
- Si l’on peut se fier à une inspection visuelle pour déterminer la propreté de l’équipement au niveau d’une limite de résidus justifiée par la HBEL.
Q8. Quelles sont les exigences pour effectuer une inspection visuelle selon la Q&R 7 ?
A. Lorsqu’ils appliquent l’inspection visuelle pour déterminer la propreté de l’équipement, les fabricants doivent établir le seuil à partir duquel le produit est facilement visible sous forme de résidu. Cela doit également tenir compte de la capacité à inspecter visuellement l’équipement, par exemple, dans les conditions d’éclairage et les distances observées sur le terrain.
L’inspection visuelle doit porter sur toutes les surfaces de contact avec le produit susceptibles d’être contaminées, y compris celles qui nécessitent le démontage de l’équipement pour y accéder voire l’utilisation d’outils (par exemple miroir, source lumineuse, endoscope) pour accéder à des zones qui ne seraient pas visibles autrement. Les surfaces qui ne sont pas en contact avec le produit et qui peuvent retenir du produit susceptible d’être délogé ou transféré dans de futurs lots doivent être incluses dans l’inspection visuelle.
Des instructions écrites précisant toutes les zones nécessitant une inspection visuelle doivent être mises en place et des registres doivent clairement confirmer que toutes les inspections ont été effectuées.
Les opérateurs chargés de l’inspection visuelle doivent recevoir une formation spécifique au processus, y compris un test périodique de la vue. Leurs compétences doivent être prouvées par une évaluation pratique.
Si ces deux nouvelles Questions/Réponses ont surpris de nombreux acteurs du secteur, les exigences relatives à la mise en œuvre de l’inspection visuelle sont maintenant plutôt bien définies comme l’une des méthodes analytiques pouvant être disponibles par l’EMA. Il suffisait de donner des indications détaillées sur la manière de satisfaire à ces critères. La nouvelle norme ASTM 3236 a été rédigée spécifiquement pour fournir les informations nécessaires à la mise en place d’un programme d’inspection visuelle qualifié afin de se conformer à ces nouvelles exigences réglementaires.
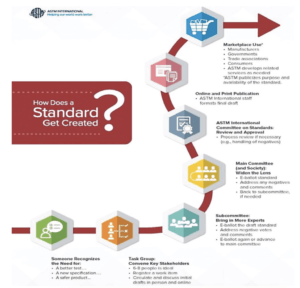
L’organisation ASTM-International
L’ASTM International est l’une des plus grandes organisations de développement de normes au monde. C’est une organisation à but non lucratif qui fournit un forum pour le développement et la publication de normes internationales volontaires, consensuelles pour les matériaux, les produits, les systèmes et les services. Les membres d’ASTM International sont bénévoles, ils représentent les producteurs, les utilisateurs, les consommateurs, les gouvernements et des universités de plus de 140 pays. La FDA possède une équipe qui travaille avec l’ASTM sur les normes pour les produits pharmaceutiques (le comité E55) et les dispositifs médicaux (le comité F04). Certains membres du personnel de la FDA dirigent même certaines équipes de normalisation. La norme E3106 a été revue et approuvée par la FDA à l’étape « main committee and Society ».
Collaboration entre les comités ASTM E55 et F04
En 2017, les membres du comité ASTM E55 sur « la fabrication de produits pharmaceutiques et biopharmaceutiques » et les membres du comité ASTM F04 sur « les matériels et dispositifs médicaux et chirurgicaux » ont collaboré à la rédaction d’un nouveau guide standard qui a abouti à l’élaboration du document E3219 “Guide standard pour la détermination des limites d’exposition basées sur la santé (HBEL) “. L’équipe qui a élaboré le guide E3219 comprenait également des membres de l’équipe E3106.
Champ d’application de la norme ASTM E3263
Le Guide E3263 fournit des procédures statistiquement valables pour déterminer la limite de détection visuelle des résidus et pour la qualification des inspecteurs pour effectuer une inspection visuelle des surfaces des équipements de fabrication pharmaceutique et des dispositifs médicaux. Le guide s’applique aux produits pharmaceutiques, y compris les principes actifs (API), les formes de dosage finies, les médicaments en vente libre, les produits vétérinaires, les produits biologiques, les essais cliniques, les dispositifs médicaux, les produits cosmétiques et les médicaments OTC. Ce guide E3263 peut être utilisé pour tous les types de résidus chimiques (y compris les APIs, les substances biologiques, les produits intermédiaires, les agents de nettoyage, les agents utilisés directement en contact avec les surfaces des équipements, etc.) qui pourraient rester sur les surfaces des équipements de fabrication ou les surfaces des dispositifs médicaux.
Le guide de pratique standard E3263
La section « Procédure » contient des orientations sur six éléments principaux. Le premier élément traite des critères initiaux à respecter pour mettre en œuvre un programme d’inspection visuelle.
1 – Critères initiaux pour la mise en place d’un programme de qualification pour l’inspection visuelle :
a) Calcul du MSSR :
Le MSSR (Maximum Safe Surface Residue) doit d’abord être calculé car il est nécessaire de déterminer le niveau minimum de résidus qui doit être détectable par l’inspection visuelle. Le MSSR, exprimé en unités de masse par surface (par exemple, μg/cm2), est calculé à l’aide de l’équation suivante (tirée de la norme ASTM E3106) :
Où :
MSC = Maximum Safe Carryover
TSA = Total Surface Area (des surfaces d’équipement partagées ou du dispositif médical)
b) Sélection des surfaces pour l’étude de qualification :
Les étapes à suivre pour sélectionner les matériaux de construction pour les études d’inspection visuelle.
c) Sélection des produits pour l’étude de qualification :
Les étapes à suivre pour sélectionner les composés/produits pour les études d’inspection visuelle.
d) Préparation des surfaces ou des dispositifs de substitution Comment préparer les surfaces de substitution (les “coupons”) à utiliser dans les études d’inspection visuelle
e) Stockage et manipulation des coupons
Comment les surfaces de substitution doivent être manipulées
f ) Conditions d’observation (éclairage)
Quelles sont les exigences en matière d’éclairage pour la réalisation des études d’inspection visuelle ?
2 – Formation des inspecteurs :
Cette section traite de ce qui est nécessaire pour former les inspecteurs/opérateurs à l’inspection visuelle et maintenir leur état de qualification.
3 – Détermination des limites visuelles de résidus :
Cette section traite de la manière d’identifier le niveau de résidus dopés le plus bas qui peut être vu par tous les inspecteurs formés pour le produit/composé d’une étude de coupon souillé.
4 – Qualification des inspecteurs par l’analyse de l’accord d’attributs
Cette section explique comment mettre en place une étude d’inspection visuelle pour qualifier un nombre d’inspecteurs/ opérateurs en analysant les résultats de l’inspection en tant qu’attributs ou de données binaires (propre/sale).
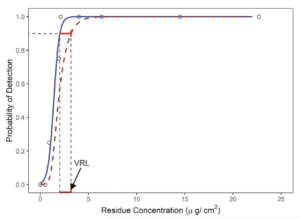
5 – Acceptation du VRL pour la validation du nettoyage
Cette section explique comment déterminer si l’inspection visuelle est appropriée par rapport au MSSR en utilisant le VDI (Visual Detection Index).
6 – Documentation
Cette section traite des documents clé nécessaires à l’établissement d’un programme d’inspection visuelle.
Importance des HBEL pour l’inspection visuelle
La considération la plus importante pour la mise en œuvre de l’inspection visuelle est probablement le HBEL du composé ou produit considéré. Il a été démontré que les limites au millième de dose (1/1000) et à 10 ppm sont prudentes voire conservatrices pour les composés à faible risque. Ces limites ne sont pas assez restrictives pour les composés à haut risque, ce qui revient à inverser une approche basée sur le risque selon l’ICH Q9. Cette erreur de logique peut être transposée à l’utilisation de l’inspection visuelle. Une simple analyse le démontre.
Les MSSR des 304 actifs médicamenteux (de l’article cité ci-dessus) ont été calculés à la fois pour les HBEL et pour la combinaison 1/1000ème de dose / 10 ppm en utilisant les paramètres suivants :
La surface totale de l’équipement a été choisie pour être typique d’une ligne de conditionnement, l’une des zones les plus appropriées pour l’inspection visuelle.
Les MSSR pour l’HBEL et de la combinaison 1/1000ème de dose / 10 ppm ont été tracés comme le montre la figure 2. Une ligne de référence pour une limite de résidus visuelle à 10μg/cm2 a été ajoutée et une case a été tracée pour contenir les composés qui sont en dessous ou peut-être trop proches de cette limite visuelle de résidus pour permettre un examen visuel. Il est évident, d’après ce graphique, que de nombreux composés, sinon la plupart, ne pourraient pas être pris en compte pour l’inspection visuelle.
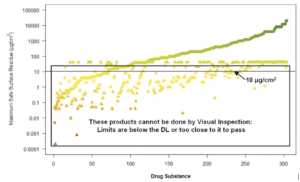
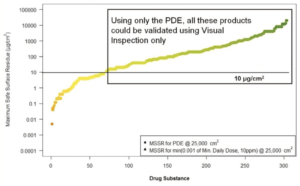
La figure 3 montre le même graphique avec les MSSR pour la combinaison 1/1000ème de dose / 10 ppm retirée. La boîte est maintenant dessinée pour contenir les composés qui sont au-dessus de cette limite de résidus visuels et qui permettraient une inspection visuelle. Il est évident d’après ce graphique, qu’avec le calcul HBELs, de nombreux composés, en particulier les composés à faible risque, pourraient être facilement considérés pour l’inspection visuelle.
Résumé
Le Q&A 7 et 8 de l’EMA a été une surprise pour bon nombre d’industriels. Elles ont permis aux compagnies ayant des produits à faible risques (selon l’approche HBEL) d’utiliser l’option de l’inspection visuelle lors du changement de produits. Partant de la discussion ci-dessus Elle montre clairement que les entreprises doivent enfin renoncer à s’en tenir aux limites historiques de 1/1000ème de la dose et des sacro-saint 10 ppm, pour mettre en œuvre l’approche HBEL, et de tirer profit de l’inspection visuelle. Il existe des positions dans l’industrie pharmaceutique, biotechnologique, du dispositif médical qui demandent le maintien de ces anciennes limites. Ce faisant, elles vont à l’encontre des principes de l’ICH Q9, qu’elles prônent d’autre part. Elles limitent également les possibilités pour l’industrie d’utiliser des méthodes de nettoyage basées sur la science, des faits et le risque, qui leur apporteraient en fait des avantages significatifs.
Dans le même temps, certaines entreprises se tournent vers l’inspection visuelle pour la libération d’équipements en laissant l’écouvillon de côté, sans aucun programme de gestion des risques, sans aucune justification adéquate, ni même un programme de qualification de leurs opérateurs. Il s’agit là de pratiques qui conduiront inévitablement à des observations réglementaires, entraînant des surcoûts et une entorse à la réputation de ces entreprises. La mise en œuvre des pratiques prévues par le guide E3263 devrait permettre d’éviter cela. Ce document E3263 ne peut être mis en œuvre sans une compréhension des guides normatifs E3106 et E3219.
Nous, auteurs, estimons que la nouvelle norme E3263 fournit les conseils et les outils scientifiques, statistiques, basés sur les risques, aux entreprises pour mettre en œuvre l’utilisation de l’inspection visuelle dans le cadre d’un programme de gestion des risques, et qui répond aux critères écrit dans les Questions N°7 et N°8 de l’EMA.
Partager l’article
Andrew WALSH – CPCI, Ralph BASILE – Healthmark Industries, Ovais MOHAMMAD – GSK Vaccines, Stéphane COUSIN – GSK Vaccines, Mariann NEVEROVITCH – BMS and Osamu SHIROKIZAWA – Life ScientiaLtd
Références
[1] European Medicines Agency, “Questions and answers on implementation of risk-based prevention of cross-contamination in production” and “Guideline on setting health-based exposure limits for use in risk identification in the manufacture of different medicinal products in shared facilities,” 19 April 2018, EMA/CHMP/CVMP/SWP/246844/2018.
[2] 21 CFR 211.67 Equipment Cleaning and Maintenance
[3] Fourman, G. L., and Mullen, M. V., “Determining Cleaning Validation Acceptance Limits for Pharmaceutical Manufacturing Operations,” Pharmaceutical Technology, Vol 17, No. 4, 1993, pp. 54–60.
[4] Jenkins, K. M. and Vander Weilen, A. J., “Cleaning Validation: An Overall Perspective”. Pharmaceutical Technology, Vol 18, No. 4, 1994, pp. 60–73.
[5] Buscalferri, F., Lorenzen, S., Schmidt, M., Schwarm, H.-M., Anhalt, E., et al., “Bestimmung der Sichtbarkeitsgrenzen von pharmazeutischen Feststoffen auf Edelstahloberflächen,” Pharm. Ind., Vol 62, No. 6, 2000.
[6] Forsyth, R. J., Van Nostrand, V., and Martin, G. P., “Visible-Residue Limit for Cleaning Validation and its Potential Application in Pharmaceutical Research Facility,” Pharmaceutical Technology, Vol 28, No. 10, 2004.
[7] Forsyth, R. J., and Van Nostrand, V., “Using Visible Residue Limits for Introducing New Compounds into a Pharmaceutical Research Facility,” Pharmaceutical Technology, Vol 29, No. 10, 2005.
[8] International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use ICH Harmonized Tripartite Guideline, Validation of Analytical Procedures: Text and Methodology – ICH Q2 (R1), www.ich.org.
[9] Desai, P., and Walsh, A., “Validation of Visual Inspection as an Analytical Method for Cleaning Validation,” Pharmaceutical Online, August 2017.
[10] Ovais, M., “Statistically Justifiable Visible Residue Limits,” Pharmaceutical Technology, Vol 34, No. 3, March 2010.
[11] EudraLex Volume 4 Guidelines for Good Manufacturing Practices for Medicinal Products for Human and Veterinary Use, Annex 15: Qualification and Validation.
[12] American Society for Testing and Materials E3106-18e1 “Standard Guide for Science Based and Risk Based Cleaning Process Development and Validation” www.astm.org.
[13] Pharmaceutical Inspection Co-operation Scheme (PIC/s), https:// picscheme.org.
[14] American Society for Testing and Materials E3219-20 “Standard Guide for Derivation of Health Based Exposure Limits (HBELs)” www.astm.org.
[15] International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use, ICH Harmonized Tripartite Guideline, Quality Risk Management – Q9, Step 4, 9 November 2005, www.ich.org.
[16] FDA Guidance for Industry: PAT – A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance, September 2004, U.S. Food and Drug Administration (FDA), www.fda.gov.
[17] Walsh Andrew, Michel Crevoisier, Ester Lovsin Barle, Andreas Flueckiger, David G. Dolan, Mohammad Ovais (2016) “Cleaning Limits—Why the 10-ppm and 0.001-Dose Criteria Should be Abandoned, Part II” Pharmaceutical Technology 40 (8)