Sommaire
- Assurance Qualité & Production : impacts de la nouvelle annexe 1 des BPF
- Un expert en inspection visuelle doit-il être un expert technique en système de vision ?
- Taux résiduel de peroxyde d'hydrogène présent dans les isolateurs lors de tests de stérilité. Quel impact sur les données générées ?
- Médicaments de thérapie innovante à base de bactéries.
- Supplier & End-User Disinfectant Qualification Comparison for Cleanrooms
- Achat de remplisseuses BFS pour un site spécialisé dans le PFS.
- Mise en œuvre d’un procédé de fabrication d’ingénierie tissulaire dans le cadre d’un MTI expérimental en thérapie cellulaire.
Taux résiduel de peroxyde d'hydrogène présent dans les isolateurs lors de tests de stérilité : quel impact sur les données générées ?
Les premiers isolateurs ont fait leur apparition à la fin du XIXème siècle notamment pour l’élevage de rongeurs axéniques. A partir du XXème siècle, les isolateurs souples ou rigides et stérilisables par voie chimique apparaissent. En Europe, la société “la Calhène” fut pionnière dans ce domaine. Depuis, les isolateurs sont utilisés dans le monde 1) des Sciences de la vie, 2) de la Pharmaceutique, 3) du Médical, 4) de l’Agroalimentaire, 5) de la Microélectronique.

Un isolateur peut être défini comme un volume clos, étanche et stérilisable, limité par des filtres HEPA dans lequel les opérateurs peuvent intervenir tout en restant biologiquement à l’extérieur de ce volume. Plusieurs fonctions leurs sont attribuées telles que leur utilisation en tant que barrière de confinement et le traitement et stérilisation de l’air et des surfaces. Les isolateurs ou boîtes à gants doivent être débarrassés de leur contamination microbiologique au moyen de méthodes de bio-décontamination par utilisation d’un gaz antimicrobien avant le début d’un procédé. Le procédé de bio-décontamination doit être validé selon la norme NF EN ISO 13408-6 : 2021. Deux grands types de décontamination sont actuellement usités, à savoir l’acide peracétique et le peroxyde d’hydrogène (H2O2). Cet article se centrera sur ce dernier.
1.Le peroxyde d’hydrogène comme moyen de décontamination
L’utilisation d’H2O2 vaporisé est réalisée en routine dans l’industrie pharmaceutique depuis les années mille neuf cent quatre-vingt. En effet, les effets bactéricides, virucides, fongicides et sporicides, ainsi que l’action sur les bactériophages du H2O2 sont bien connus et son utilisation sous forme liquide ou gaz pour la décontamination a été établie au cours des deux dernières décennies pour devenir une méthode standard dans l’industrie pharmaceutique. L’H2O2 agit par dénaturation des protéines grâce à son effet oxydant puissant, plus important que celui de l’acide hypochloreux. Néanmoins, il présente une certaine toxicité sur les cellules humaines, son mécanisme cytotoxique étant basé sur la production de radicaux hydroxyles OH hautement réactifs. Par ailleurs, il a été mis en évidence un seuil de toxicité pulmonaire à 10 mg.m-3 (7.6 ppm), avec une NOEL (Non Observed Exposure Limit) à 5 mg.m-3 (3.8 ppm) chez des volontaires sains exposés à des aérosols de 5 minutes à 4h (Ranjit, 2020).
Par ailleurs, ce procédé par voie chimique est fonction de la concentration d’H202 vaporisé présent dans l’ambiance de la chambre, puis condensé à la surface de la charge. L’humidité relative en début de cycle, la température, l’efficacité du brassage et l’homogénéité de distribution du fluide décontaminant sont des paramètres qui influencent un cycle de bio-décontamination répétable et valide. La bio-décontamination peut se découper en plusieurs phases à savoir un test d’étanchéité, un conditionnement, une injection, une stabilisation et une phase d’aération qui réduit la concentration d’H202 jusqu’à un niveau compatible avec les activités se déroulant dans l’isolateur. Cette concentration résiduelle en H202 affecte potentiellement les molécules actives des produits pharmaceutiques. Par conséquent, les autorités, comme pour les VLEP recommandent des limites d’exposition pondérées dans le temps entre 0.5 et 1.0 ppm.
Pour rappel, les User RequirementSpécifications (URS) concernant les isolateurs pour tests de stérilité necessitant une bio-décontamination au H202 n’intégraient auparavant aucune demande particulière sur le temps de rinçage, pas même la mesure du taux résiduel d’agent stérilisant. Etait généralement stipulé dans ces URS : “Un rinçage approprié” sans mention de valeur de concentration H202 en ppm. L’important était de vérifierplus la compatibilité de l’agent stérilisant avec les matériaux et de montrer une réduction de spores à 6Log dans un temps imparti que de vérifier le taux résiduel. Des taux résiduels de 5, 3 puis 1ppm ont ensuite été demandés avec un temps de rinçage rapide sans se soucier de la désorbtion des emballages en polymèreou tyvek. Néanmoins, pour atteindre ces valeurs basses de concentrations résiduelles, les temps de rinçage et d’attente peuvent être important engendrant des coûts d’immobilisation.
2. Objet de l’étude
En s’appuyant sur le paragraphe 2.6.1. de la Pharmacopée Européenne (2020), l’objet de cette étude préliminaire était d’évaluer si un test de stérilité n’engendrait pas de faux négatifs lorsqu’il étaitréalisé dans un isolateur avec un taux résiduel d’H202 supérieur à 1 ppm, suite à sa bio décontamination.
3. Matériels et Méthodes
3.1 Matériel utilisé
a.Isolateur utilisé
Pour ce faire trois tests de stérilité à une concentration d’H202 résiduel de 5 ppm ont été réalisés dans un l’isolateur 3 Gants intégrant un sas de bio-décontamination. Un test de référence à une concentration d’H202 résiduel de 0 ppm a également été effectué, la concentration résiduelle étant mesurée par une sonde de type (Dräger H202 LC sensor).
b. Produits à tester
Ces tests de stérilité sont réalisés sur des lingettes stériles (Référence 3035500 de Ecolab KlerwipeTM).
c. Préparation et stérilisation des milieux de culture utilisé
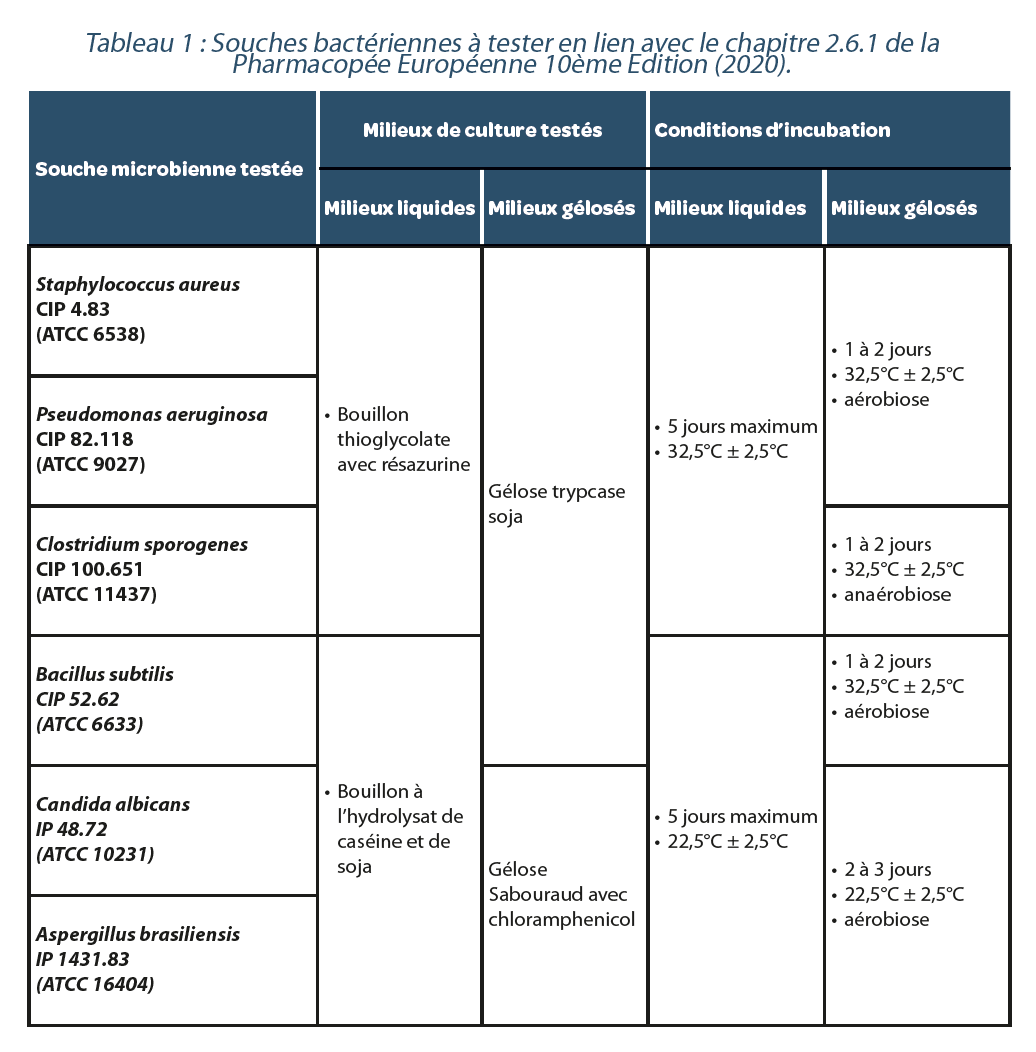
La stérilité de chaque lot de milieu de culture fabriqué a été assurée conformément à la norme NF EN ISO 17665-1: 2006, “stérilisation des produits de santé”. La fertilité de chaque lot de milieu de culture a été vérifiée avant utilisation en accord avec le paragraphe “fertilité des milieux” de l’essai, chap. 2.6.12 de la Pharmacopée Européenne 10ème Edition (2020), les milieux de culture utilisés étant de la gélose Trypcase-soja, de la gélose de Sabouraud avec chloramphenicol, du bouillon à l’hydrolysat de caséine et soja, du bouillon de Thioglycolate avec résazurine.
d. Microorganismes testés et conditions de culture
Le Tableau 1 présente les microorganismes testés et leurs conditions de culture. Ces microorganismes ont été utilisés sous forme d’inocula calibré, titré entre 10 et 100 UFC.0.1ml-1, mis au point par la société ICARE. (voir Tableau1)
3.2 Méthodes
a. Préparation
Pour chaque test de stérilité ont été placé sous isolateur avant décontamination :
- 8 bocaux contenant 500 ml de bouillon à l’hydrolysat de caséine et de soja
- 8 bocaux contenant 500 ml de bouillon thioglycolate avec résazurine
- 1 paquet de 10 lingettes stériles
- 8 pinces stériles
- 1 micropipette 20-200 µl emballée en sachet stérile
- 1 boite d’embouts de micropipette 200 µl emballée en sachet stérile
Une fois ce matériel déposé, 3 indicateurs biologiques de Geobacillus stearothermophillus ATCC 7953 à 106 spores/indicateur biologique ont été placés dans l’isolateur. En effet, la Ph.Européenne 10ème édition et l’USP 31 recommandent l’utilisation de Geobacillus stearothermophilus pour la validation de la méthode de stérilisation, car c’est la souche la plus résistante à l’H202. Elle est plus résistante que les spores de Bacillus subtilis, les Bacillus étant des bactéries gram+ aérobies qui produisent des endospores connues pour leur grande résistance à la chaleur, aux produits chimiques, à la sécheresse. Leur viabilité dans des milieux pauvres en nutriments est également bien connue. Un cycle de bio-décontamination à l’H202 de l’enceinte de l’isolateur a alors été démarré.
b. Bio-décontamination de l’isolateur
Le système de bio-décontamination utilisé pour cette étude était un générateur d’H202 de type STELEC® transformant sous forme de vapeur par effet thermique l’H202. L’agent de décontamination H202 35% (RAIDOX) a été vaporisé via un gaz vecteur dans le volume à bio-décontaminer selon des paramètres prédéfinis intégrant le temps, la pression, le taux d’humidité, la température, le volume, le taux et la vitesse d’injection, ceci permettant d’atteindre une destruction de 6 Log sporicide. La durée de la phasede bio-décontamination pour cet essai était de 60 min. Un enregistrement en continu des paramètres suivant via IHM (Siemens, France) a été effectué : taux d’humidité, quantité d’agent stérilisant, température d’évaporation, température de diffusion, temps de diffusion, de contact et d’aération, pression de diffusion, débit d’air de diffusion, concentration haute et basse de l’H202. Une ventilation de l’isolateur d’une durée de 10 minutes a été réalisée via un système catalytique jusqu’à atteindre la concentration cible d’H202 résiduel à tester, à savoir 5%. A la suite de ces opérations, a été réalisé un test de stérilité.
c. Réalisation du test de stérilité
Dès l’atteinte de la concentration d’H202 résiduel cible dans l’isolateur (5ppm), des tests de stérilité par ensemencement direct ont été réalisées suivant la méthodologie du paragraphe 2.6.1. de la Pharmacopée Européenne (2020) : pour chaque microorganisme testé, un bocal de milieu de culture adapté au microorganisme testé a été ouvert durant 6 secondes afin de placer une lingette stérile (= Essais), un autre bocal a été ouvert puis refermer sans placer de lingette stérile (= Témoins validation). Il est à signaler que ce temps de contact avec l’air est identique avec ce que l’on peut enregistrer lors des tests de stérilité par ensemencement direct réalisé dans les laboratoires. Pour chaque type de milieu de culture utilisé, des témoins négatifs ont été réalisés de la même manière que les Essais et Témoins validations (= Témoins négatifs essais et Témoins négatifs validation respectivement).Tous les bocaux de milieux de culture ont ensuite été refermés en attendant la ventilation complète de l’isolateur.
Lors du retour à une concentration d’H202 résiduel dans l’isolateur de 0 ppm (environ 15 minutes), des inocula calibrés des souches microbiennes à tester ont été placées dans le sas de transfert de l’isolateur, emballés dans un sac plastique stérile. Un cycle de décontamination du sas de transfert à I’H202 a ensuite été effectué avant de faire passer les inocula calibrés dans la chambre de l’isolateur. Ce cycle de décontamination a duré 75 minutes. Dix à 100 microorganismes de chaque souche microbienne à tester (confère Tableau 1) ont ensuite été inoculés, chacune dans un des bocaux de milieu de culture adapté contenant une lingette (“Essai”) et dans un récipient de milieu de culture adapté sans lingette ( “Témoin validation”). Les “Témoins négatifs essais” et “Témoins négatifs validation” n’ont pas été contaminés au moyen des inoculas calibrés.
d. Contrôles réalisés
En parallèle, pour chaque souche microbienne testée, un contrôle du nombre de microorganisme inoculé a été fait par dénombrement sur plaque de gélose adapté à chaque microorganisme (voir Tableau 1). Ceci a été réalisé en déposant sur le milieu de culture gélosé adapté (2 boîtes par souche) le volume utilisé en µl d’inocula calibré de chaque microorganisme. Pour chaque cycle de décontamination réalisé, des indicateurs biologiques de Geobacillusstearothermophilus ATCC 7953 ont été disposés dans l’isolateur afin de contrôler l’efficacité duprocédé de désinfection, ainsi qu’un indicateur biologique non exposé (témoin positif). Ces indicateurs biologiques ont été mis en culture dans des tubes de milieu liquide à l’hydrolysat de caséine et de soja (Spordex culture media, STERIS).
e. Incubation
Après réalisation des tests de stérilité par inoculation directe, les bocaux de milieux liquides ainsi que les milieux de culture gélosés ont été incubés dans des étuves à températures maitrisées, en accord avec les conditions de culture exposées dans le Tableau 1. Pour la souche bactérienne Clostridium sporogenes ATCC 11437, les milieux de culture gélosés ont été placé dans des sachets plastique fermés hermétiquement, contenant des générateurs d’anaérobiose (Kit GENbag anaer, Biomérieux) ainsi que des indicateurs d’anaérobiose (ThermoScientific). Pour chaque cycle de décontamination réalisé, les indicateurs biologiques de Geobacillus stearothermophilus ATCC 7953 disposés dans l’isolateur afin de contrôler l’efficacité du procédé de désinfection, ainsi qu’un indicateur biologique non exposé (témoin positif), ont étémis en culture dans des tubes de milieu liquide à l’hydrolysat de caséine et de soja (Spordex culture media, STERIS) et incubés à 58°C ± 2°C pendant 7 jours. Après incubation, les quantités de germes inoculées à l’aide des inocula calibrés ont été déterminé par comptage sur les milieux de culture gélosé. Les bocaux de milieux de culture liquides et les cultures des indicateurs biologiques de Geobacillus stearothermophilus ATCC 7953 ont été examinées pour déceler les signes macroscopiques d’une prolifération microbienne (croissance microbienne en cas de présence de trouble).
4. Résultats
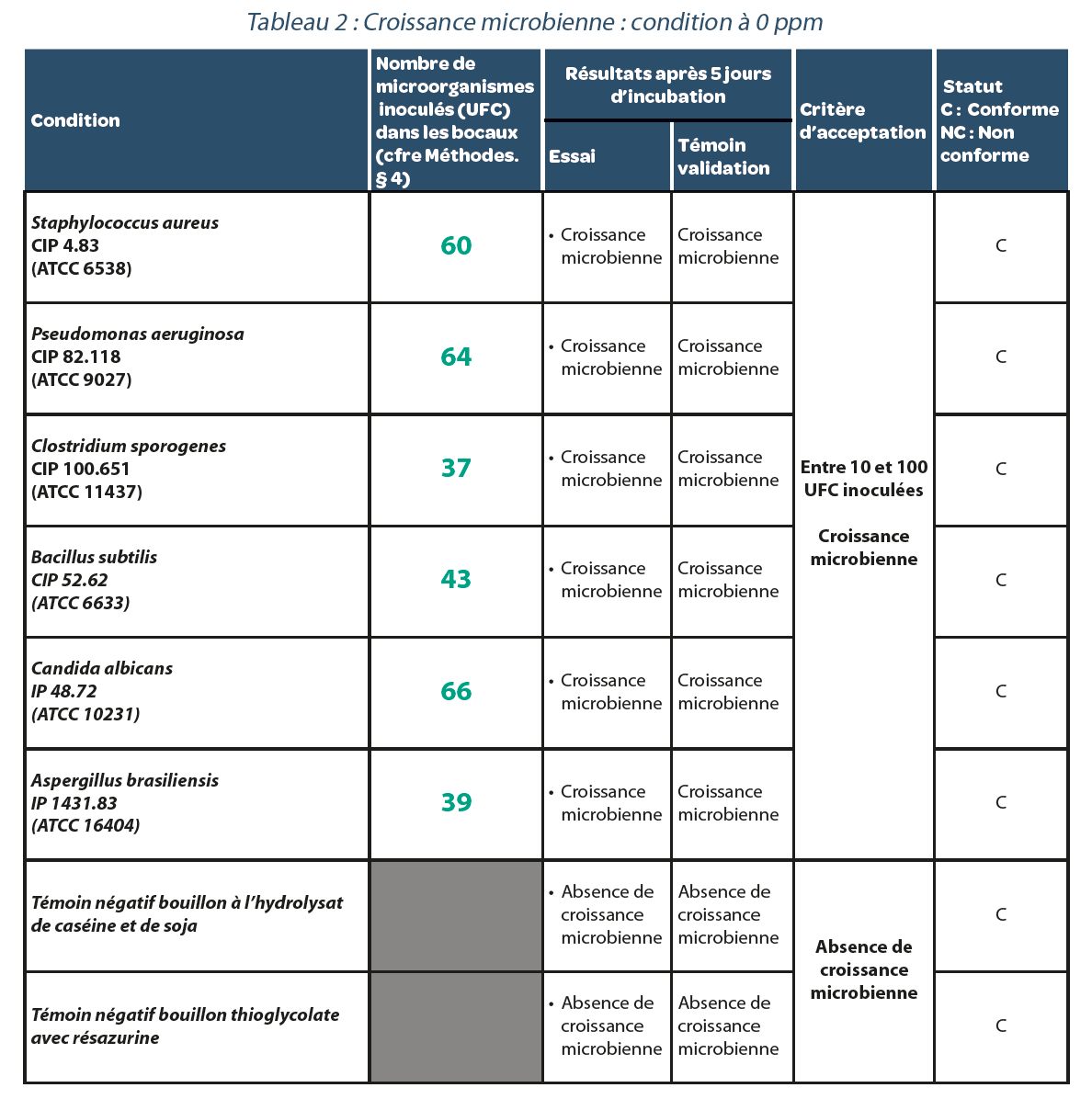
4.1. Test de référence. Validation d’une méthode de test de stérilité dans un isolateur décontaminé à l’H202.
Valeur résiduelle après décontamination : 0 ppm.
Quelle que soit la souche bactérienne étudiée, et après 5 jours d’incubation, (Tableau 2), chacune d’entre elle a donné lieu à une croissance microbienne. Ainsi un cycle de stérilisation dans un isolateur décontaminé avec une concentration résiduelle en H202 de 0 ppm ne génère pas de faux négatifs.
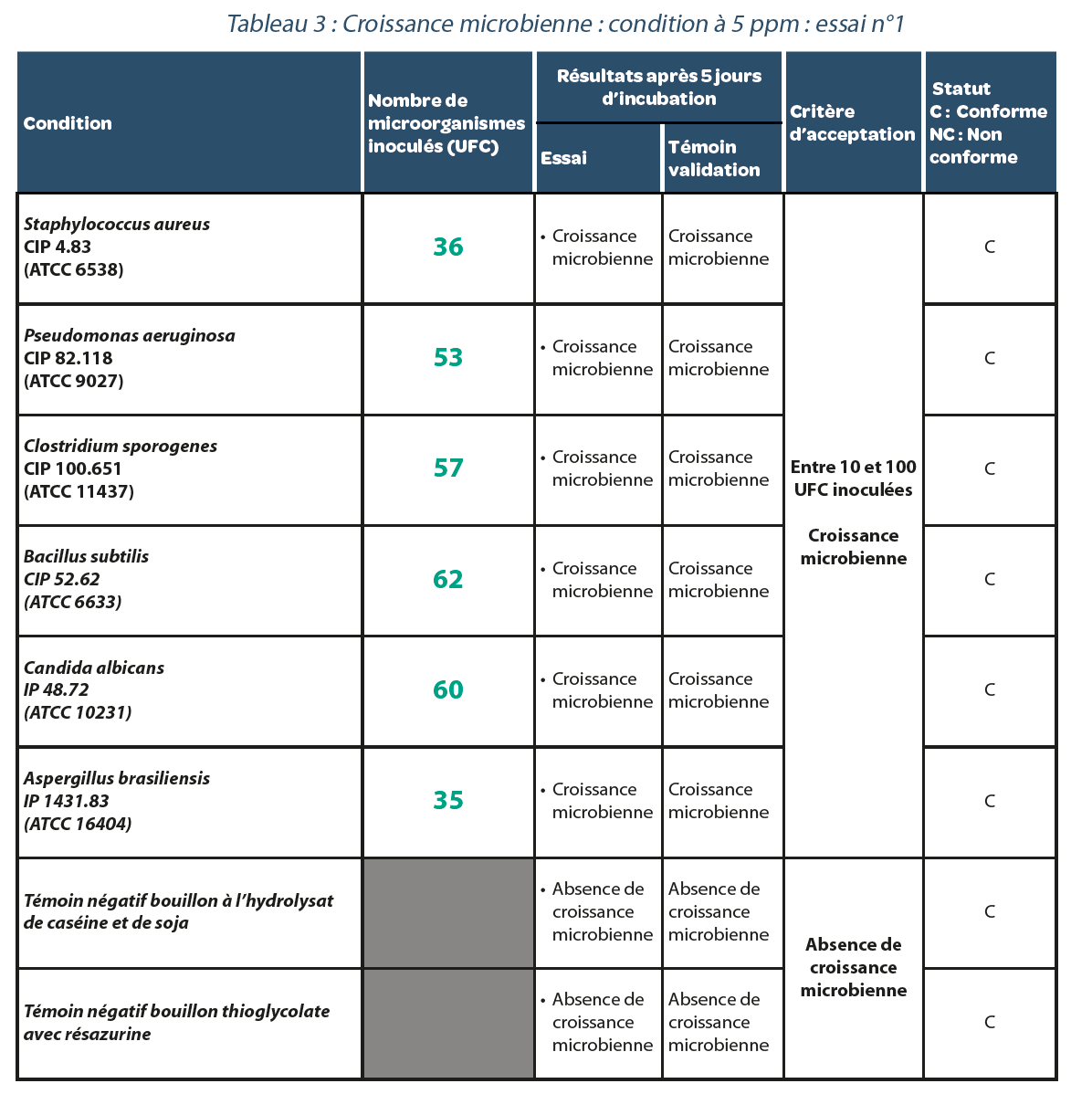
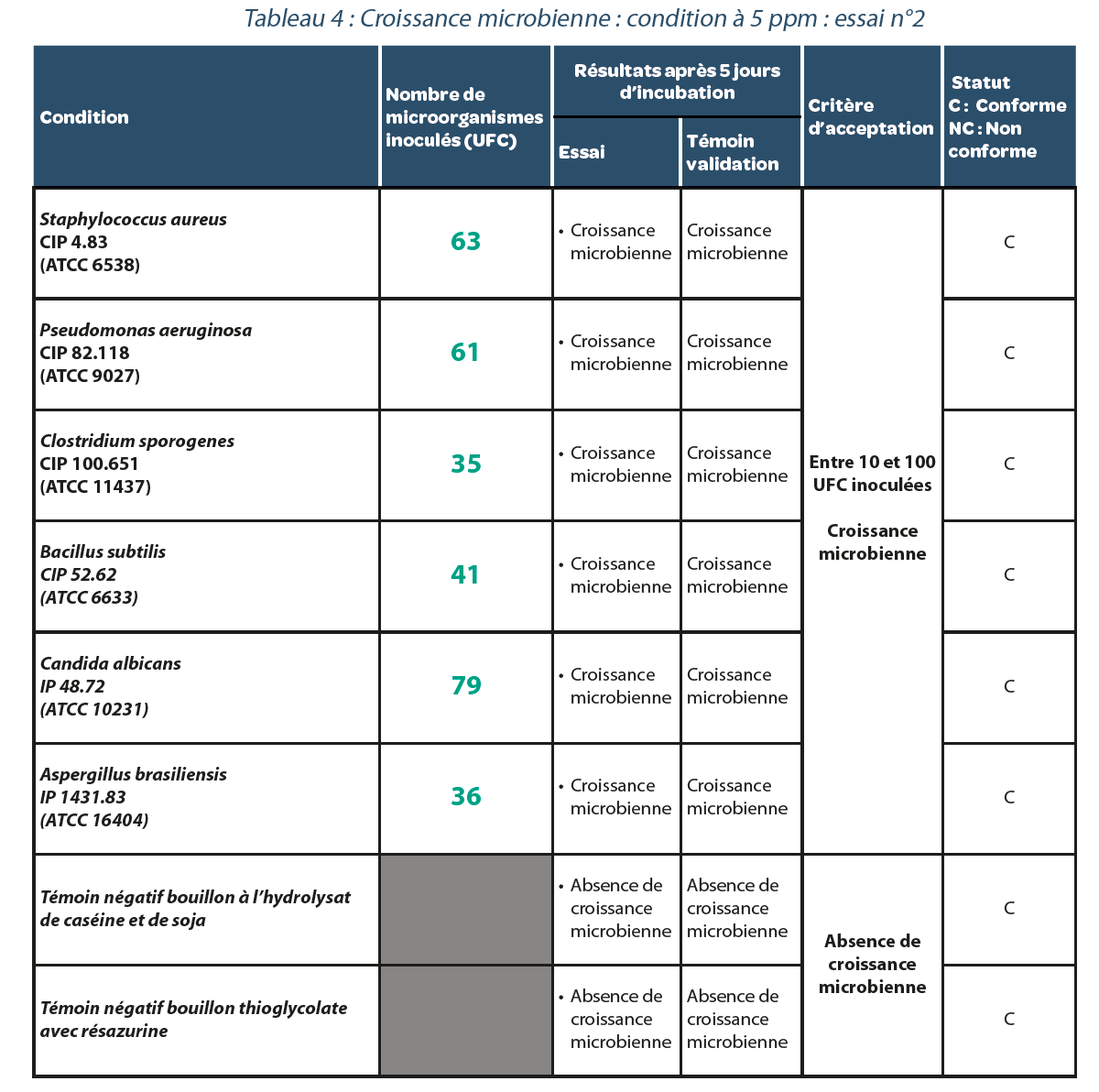
4.2. Validation d’une méthode de test de stérilité dans un isolateur décontaminé à l’H202.
Valeur résiduelle après décontamination : 5 ppm.
Trois réplicats ont été réalisés. Les résultats sont reportés dans les Tableaux, 3, 4 et 5. Comme dans le cas précédent, pour chaque répétition de l’expérimentation avec une concentration résiduelle de 5 ppm d’H202 dans l’isolateur, toutes les souches bactériennes étudiées présentaient une croissance microbiologique suggérant qu’aucun faux négatif n’était généré dans ces conditions.
4.3. Bio-décontamination
La Figure 1 représente un cycle de bio-décontamination. La remontée de la concentration au début du rinçage est due à une désorption de l’H202. Il est à noter que, pour chaque cycle de décontamination réalisé, les indicateurs biologiques ne présentaient pas de croissance, ce qui reflète une efficacité de la bio-décontamination.
5. Discussion & conclusion
Dans de nombreuses applications pharmaceutiques, la maîtrise des risques de contamination est un enjeu capital. Ces activités nécessitent des lieux classés en zone propre selon la norme ISO 14644. L’industrie pharmaceutique exploite donc des zones à atmosphère contrôlée (ZAC) exigeant une maîtrise des risques de contamination microbienne ainsi que des procédés de bio-décontamination. Parmi ces ZAC on retrouve les isolateurs. Les processus de décontamination reposent sur de hautes concentrations de peroxyde d’hydrogène (jusqu’à 35%) en milieu clos. Par ailleurs, comme tout cycle de décontamination doit être validé, le choix des indicateurs biologiques est stratégique afin d’obtenir des données dites “worst case”. La souche bactérienne la plus communément utilisée avec H202 est la souche Geobacillus stearothermophillus ATCC 12980, souche que nous avons utilisé lors du processus de bio-décontamination.
Notre étude montre que dans les conditions de l’expérimentation, des tests de stérilité effectués dans un isolateur ayant une valeur résiduelle d’H202 de 5 ppm ne semblent pas impacter des tests de stérilité et donc engendrer de faux négatifs Ce résultat est très intéressant dans la mesure où les temps de rinçage pour revenir à des concentrations en H202 < à 1 ppm (relargage, désorption des emballages…) peuvent engendrer des arrêts de production augmentant ainsi les coûts. Nous avons choisi délibérément d’utiliser des tests de stérilité par ensemencement direct, test qui sont préconisés pour les dispositifs médicaux solides.
Néanmoins, il serait opportun de réaliser cette même étude en s’appuyant sur une méthode par filtration, méthode la plus courante en pharma. De la même manière, d’autres expérimentations sont nécessaires pour évaluer la valeur limite des concentrations résiduelles en H202.
Partager l’article

Remerciement
L’ensemble de ces tests ont été réalisés en collaboration avec la société ICARE, située à Saint Beauzire (63), et possédant une grande expertise dans la maîtrise de la sécurité des produits de santé.
Références
Références
- Doriath C. Cycle H202 : acceptation paramétrique pour remplissage aseptique. La Vague. 2009, 28 : 7-10.
- Guide de l’Ultra-Propreté 2008-2009, 6ème édition, BCMI, Neuilly-sur-Seine, 2008.
- INRS. Peroxyde d’hydrogène et solutions aqueuses. Fiche toxicologique, n° 123. 2022.
- Kleinmann S, Scheu M. Advanced vaporized H202 decontamination technology for pharmaceutical isolators: Reduction of H202 decontamination cycle time using direct iniection nozzles. La Vague. 2017, 52: 31-38.
- Meyer D. Barrières : le confinement souple appliqué aux systèmes de protection rapprochée. Salles Propres. 1979. n°55 : 23-26.
- Mounier C. Maîtrise des paramètres et des aléas d’une biodécontamination à l’H202. Salles Propres, 2010, 69 : 1-5.
- Pharmacopée Européenne 10ème Edition. Chap. 2.6.1. Editeur : Conseil de l’Europe; 2020
- Ranjit N. Mesure des résidus en peroxyde d’hydrogène après stérilisation basse température : existe-t-il un risque. Sciences Pharmaceutiques, 2020.
- ✻