Sommaire
- La campagne on y gagne ! Le travail en mode campagne, une avancée sur la productivité des isolateurs.
- Inspection visuelle : principaux constats des inspections de l’ANSM
- Validation des nettoyages des équipements de production : Contrôle visuel, habilitation du personnel au « visuellement propre »
- A Refresher on Disinfectant Wet Contact Time
- RDM et RDIV de l’UE : Les produits combinés désormais soumis au même degré de surveillance que les dispositifs médicaux autonomes
- Fiabilité de la lignée monocytaire Mono-Mac-6 pour la détection des pyrogènes endotoxiniques et non-endotoxiniques
- Indicateurs biologiques, pousses aléatoires - votre cycle de décontamination est-il réellement en cause ?
- Determining a Strategy for Container Closure Integrity Testing of Sterile Injectable Products
- Efficient Control Strategy enabled by structured Knowledge
- Une solution performante pour les dénombrements en temps réel des colonies sur membranes dans l’analyse microbiologique avec ScanStation
Inspection visuelle : principaux constats des inspections de l’ANSM
La présence de particules visibles dans les préparations parentérales a longtemps été et demeure un sujet de préoccupation majeur pour les industriels et les autorités de santé. En effet, la présence de particules visibles dans une préparation parentérale peut remettre en cause sa sécurité (1).
Par conséquent, il est attendu que la présence de particules visibles soit réduite autant que possible dans l’ensemble des préparations parentérales.

L’évolution récente des textes normatifs et réglementaires montre l’intérêt actuel pour le renforcement de l’inspection visuelle, ou « mirage », des médicaments injectables qui est une étape fondamentale pour la sécurisation de leur production (1,4,5).
Les rappels de lot pour la présence de particules dans les préparations parentérales représentent un contingent important en France. Ainsi, en 2016, ils ont été à l’origine de 10% de l’ensemble des rappels de lots des préparations parentérales, 17 % pour 2017 et 20% pour 2018.
L’ANSM a réalisé une étude afin d’évaluer l’état actuel des pratiques d’inspection visuelle des sites fabricants de préparations parentérales ou de médicaments de thérapie innovante (MTI) pour lesquelles elle réalise des inspections selon l’annexe 1 des bonnes pratiques de fabrication (BPF) (2) ou les bonnes pratiques de fabrication des médicaments de thérapie innovante (BPF-MTI) le cas échéant (3).
1. Méthodologie de l’étude
L’étude a consisté à effectuer une revue de l’ensemble des rapports d’inspection des établissements pharmaceutiques fabricants de préparations parentérales sur la période de janvier 2016 à juin 2019 de manière à disposer de données sur les écarts d’inspection relevés. Une différenciation entre les sites fabricants de médicaments chimiques et les sites fabricants des médicaments biologiques (60 sites fabricants de médicaments biologiques et 44 sites fabricants de médicaments chimiques) a été réalisée afin de rechercher des éventuelles spécificités en fonction du domaine considéré. L’ensemble des écarts relevés dans les rapports d’inspection (critique, majeur et autre) ont été pris en compte et les suites administratives éventuelles ont été étudiées dans le cas où des écarts critiques ou majeurs avaient été relevés.
Les établissements concernés par l’étude réalisée étaient situés aussi bien en France (90%) qu’à l’étranger (10%) dans le cadre d’inspections réalisées pour le compte de l’Agence Européenne du Médicament (EMA) ou en support de l’Organisation Mondiale de la Santé (OMS). Pour les médicaments biologiques, une grande diversité des établissements a été observée, tels que les fabricants de MTI, de vaccins, des établissements réalisant le fractionnement du plasma, et comprenaient des structures privées ou publiques.
Dans le but d’analyser les résultats obtenus et d’identifier les problématiques les plus fréquemment rencontrées dans les différents rapports d’inspection, huit sous-catégories (1. Procédés, 2. Documentation, 3. Analyse de tendance, 4.Habilitation du personnel, 5. Environnement (Conditions) de mirage, 6. Défauts et défauthèque, 7. Niveau de qualité Acceptable (NQA), 8. Qualification/validation des machines automatisées) ont été définies. Il est toutefois important de souligner qu’un même écart peut avoir été rattaché à plusieurs sous- catégories, quand des problématiques différentes y sont rapportées. De plus, la criticité des écarts a également été étudiée de manière à définir les sous-catégories génératrices des écarts d’inspection les plus critiques.
Sur la période étudiée, 161 inspections BPF ont été réalisées, qui ont concerné 104 établissements différents, certains établissements ayant fait l’objet de réinspections.
Les références opposables en vigueur suivantes, au moment de l’étude, ont été utilisées pour la recherche des écarts relevés en lien avec l’inspection visuelle : BPF Ligne Directrice 1 point 124, la Pharmacopée européenne 2.9.20, BPF-MTI 9.85 et BPF-MTI 2.42. Cependant, il faut souligner que les BPF-MTI sont applicables depuis mai 2019 et peu d’écarts ont été relevés selon cette référence réglementaire au moment de l’étude.
2. Résultat de l’étude
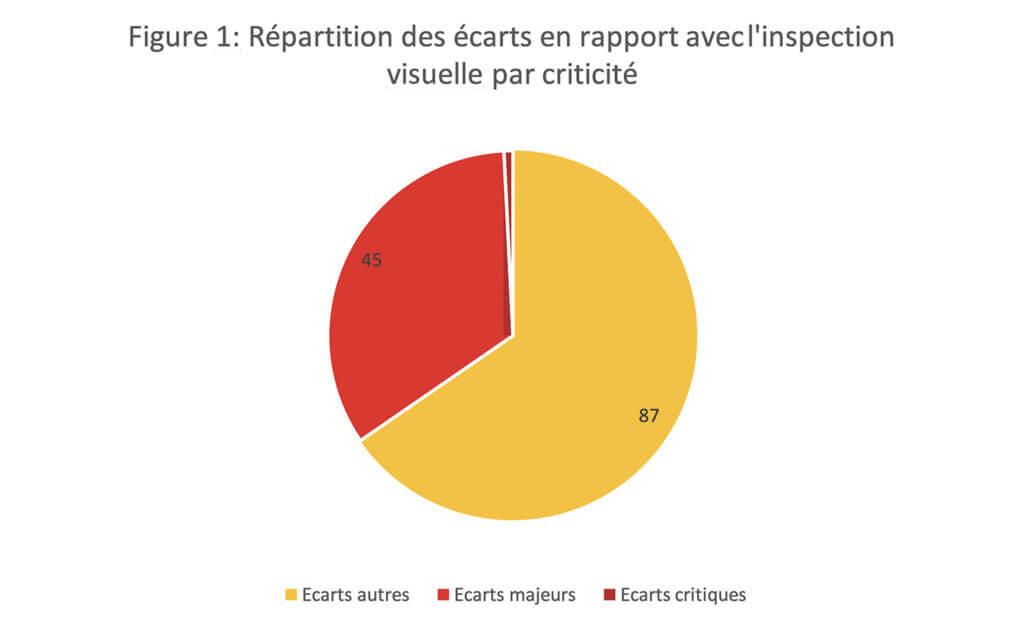
133 écarts ont été relevés en lien avec l’inspection visuelle pour 75 inspections, soit une moyenne approximative de 2 écarts par inspection. Au total, 51 établissements sur les 104 établissements inspectés ont eu des écarts relatifs à l’inspection visuelle, soit près de la moitié des sites inspectés. La répartition des écarts en fonction de leur criticité est la suivante : 87 écarts autres, 45 écarts majeurs et 1 écart critique (figure 1).
133 écarts ont été relevés en lien avec l’inspection visuelle pour 75 inspections, soit une moyenne approximative de 2 écarts par inspection. Au total, 51 établissements sur les 104 établissements inspectés ont eu des écarts relatifs à l’inspection visuelle, soit près de la moitié des sites inspectés. La répartition des écarts en fonction de leur criticité est la suivante : 87 écarts autres, 45 écarts majeurs et 1 écart critique (figure 1).
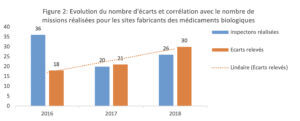
L’évolution du nombre d’écarts par année pleine de 2016 à 2018 pour les sites fabricants de médicaments biologiques (figure 2) montre une augmentation du nombre d’écarts qui n’est pas corrélée au nombre de missions réalisées. Il en est de même pour les sites fabricants de médicaments chimiques où une augmentation sensible est également observée et qui n’est pas corrélée au nombre de missions réalisées.
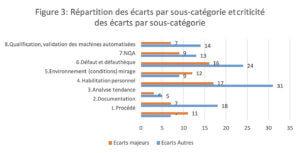
La répartition des écarts par sous-catégorie (figure 3) montre que les sous-catégories 4 « habilitation du personnel » et 6 « défauts/défauthèque » ressortent clairement comme les problématiques majoritaires relevées lors des inspections BPF. La répartition de la criticité des écarts par criticité révèle que les sous-catégories 1 « procédés » et 5 « environnement » (conditions) de mirage présentent une proportion élevée d’écarts majeurs suivies par la sous- catégorie 3 « analyses de tendance ».
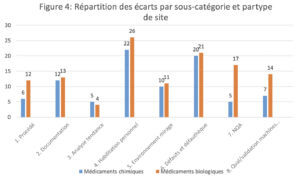
La répartition des écarts par sous-catégorie en fonction du type de site (chimique ou biologique) est légèrement différente (figure 4). Les sites fabricants de médicaments biologiques ont un plus grand nombre d’écarts en rapport avec les procédés, le NQA et la qualification/validation des machines automatisées. Cette différence peut s’expliquer en grande partie par une plus forte automatisation de l’inspection visuelle pour les sites fabricants des médicaments biologiques par rapport aux sites fabricants des médicaments chimiques.
Les suites administratives (rappel à la loi, lettre préalable à injonction et injonction) associées aux différents écarts majeurs et critiques relevés lors de la période étudiée ont également été étudiées. Parmi les 75 inspections pour lesquelles il a été relevé au moins un écart en lien avec l’inspection visuelle, 23% ont donné lieu à des suites administratives et il s’agissait de lettres d’injonction dans la moitié des cas. Il est à souligner que les actions correctives en lien avec l’inspection visuelle peuvent s’étendre dans le temps (de 9 à 12 mois) car elles nécessitent très souvent une remise en question profonde des procédés d’inspection visuelle à partir du moment où les fondamentaux méthodologiques doivent être modifiés.
3. Discussion
La sous-catégorie 1 « Procédés » regroupe l’ensemble des écarts en lien avec les fondamentaux de l’inspection visuelle et qui reflètent la stratégie globale de l’inspection visuelle adoptée par le site concerné. Les rejets de l’inspection visuelle qui sont remirés une nouvelle fois sans justification et l’évolution du taux de faux-rejets qui n’est pas maitrisée au cours de l’inspection visuelle représentent les écarts les plus communément retrouvés dans cette sous-catégorie. En effet, le remirage des rejets issus d’une première inspection visuelle ne pourrait se faire sans la justification de la pertinence de ces rejets (4). La présence de bulles ou d’autres artéfacts dans le produit communément revendiqués comme étant à l’origine de potentielles opérations de remirage, doivent être démontrés et ceci, pour chaque produit miré. Un taux de faux-rejets évolutif dans le temps doit être considéré comme un critère qualitatif car il peut également être l’élément précurseur d’une configuration non viable du procédé d’inspection visuelle et d’un défaut de paramétrage, voire même d’un défaut de qualification de l’équipement d’inspection visuelle.
La sous-catégorie 2 « Documentation » regroupe l’ensemble des écarts en lien essentiellement avec des défauts de traçabilité des opérations d’inspection visuelle. Par conséquent, cette sous-catégorie n’est pas spécifique à l’inspection visuelle et ne sera pas davantage commentée dans le cadre de cette étude.
La sous-catégorie 3 « Analyse de tendance » regroupe l’ensemble des écarts en lien avec le suivi de l’évolution des défauts relevés pour chacun des produits étudiés. Ces analyses de tendance sont attendues par type de produit considéré, le regroupement de plusieurs produits différents dans une même analyse de tendance n’étant pas opportun sauf justification solidement établie. L’objectif de ces analyses de tendance étant d’alerter suffisamment en amont de toute dérive du système d’inspection en place (5), il est attendu par conséquent l’établissement de niveaux d’alerte et d’action pour les différentes catégories de défauts et par produit de manière à mettre en place les actions correctives et préventives nécessaires avant le dépassement du seuil d’action. En cas de dépassement des limites d’alerte et d’action, une recherche de causes les plus probables devra être réalisée et les actions correctives nécessaires devront être déployées avant la reprise des opérations d’inspection visuelle.
La sous-catégorie 4 « Habilitation du personnel » est la sous-catégorie présentant le contingent le plus important d’écarts dans le cadre de cette étude. La problématique principale relevée est en lien avec une cadence d’inspection visuelle appliquée en production mais pour laquelle il n’existe pas ou très peu d’éléments issus de la qualification des opérateurs de production permettant de la justifier. De plus, très souvent les conditions de qualification ne prennent pas en compte les conditions de « fatigue » des opérateurs en fin d’équipe (5) ainsi que les temps de pause définis qui doivent aussi être justifiés. L’autre problématique relevée est en lien avec des conditions d’habilitation des opérateurs, où les critères d’acceptation ne sont pas établis ou insuffisamment établis : par exemple le nombre d’unités non conformes à détecter parmi les conformes, le pourcentage de détection des défauts critiques et majeurs lors de l’habilitation et le nombre d’essais (« runs ») de qualification initiale et périodique.
La sous-catégorie 5 « Environnement (conditions de mirage) » regroupe les écarts en lien avec des paramètres d’inspection visuelle qui sont non définis ou insuffisamment définis au cours de la production. Il s’agit par exemple, de paramètres de recettes pour des équipements d’inspection visuelle semi-automatique qui ne sont pas figés au cours de la production, d’absence de vérification de la vitesse de transfert des unités mirés pouvant avoir un impact sur la reproductibilité des opérations de mirage et de paramètres de rotation des unités à inspecter qui sont déterminés en qualification mais non fixés en production de routine. Les conditions optimales de luminosité et la vérification (métrologique notamment) sur une base régulière des paramètres de luminosité font également partie des écarts régulièrement relevés dans cette sous-catégorie.
La sous-catégorie 6 « Défaut et défauthèques » est la deuxième sous-catégorie, après l’habilitation du personnel, qui présente le nombre le plus important d’écarts relevés dans le cadre de cette étude. De manière générale, les défauts à rechercher lors de l’inspection visuelle dans un produit donné sont les défauts connus pour ce produit (au cours du développement du produit et collectés lors de la production en routine), répondant à la définition « après la répartition, les produits à usage parentéral doivent subir un contrôle individuel destiné à détecter tout corps étranger ou tout autre défaut » comme précisé dans les BPF (2, 5). Les défauts tels que l’opalescence, coloration, turbidité ou présence de précipité communément listés dans les défauts critiques et devant être recherchés dans le cadre de l’habilitation du personnel et la qualification des équipements de mirage semi-automatique et automatique le cas échéant, ne sont pas toujours efficacement recherchés en inspection visuelle automatique alors que ces mêmes défauts sont détectés aisément en inspection manuelle. En ce qui concerne les défauthèques, les défauts représentés ne sont pas toujours préférentiellement collectés de la production mais majoritairement créés ce qui peut apporter un biais lors de l’habilitation des opérateurs de production et la qualification des équipements de mirage. Il est communément admis que certains défauts ne pourront pas être collectés à partir de la production, du fait de leur rareté par exemple, et devront le cas échéant faire l’objet d’une justification. Dans le cas où les défauts sont créés, les modalités de création et de constitution des défauts devront être définies ainsi que les modalités de leur maintien dans le temps.
La sous-catégorie 7 « NQA (Niveau de Qualité Acceptable) » représente les écarts en lien avec un contrôle supplémentaire (après l’inspection individuelle de chaque contenant) souvent réalisé selon un plan d’échantillonnage reposant sur un effectif d’échantillon et une valeur d’acceptation déduits des tableaux définis dans la norme ISO2859-1 ou par une autre méthode statistique (1). Il est essentiel de définir des limites de NQA pour chaque catégorie de défauts et en cas de dépassement des limites de NQA, une investigation devra être ouverte. L’effectif de l’échantillon pris en compte pour le calcul du NQA devra aussi reposer sur la quantité d’unités réellement produites. En cas de réinspection visuelle et après ouverture d’une investigation, il est attendu qu’un contrôle avec un NQA renforcé (de niveau III par exemple) soit réalisé par un opérateur n’ayant pas participé à l’inspection initiale du lot, de manière à assurer l’indépendance du contrôle renforcé réalisé par rapport au contrôle initial.
Enfin, la sous-catégorie 8 « Qualification et validation des machines automatisées » regroupe la qualification des machines semi-automatisées et automatisées ainsi que la validation des procédés d’inspection visuelle. L’inspection visuelle semi-automatisée ou entièrement automatisée peut être réalisée sous réserve de validation par rapport à l’inspection manuelle, qui reste la référence de l’inspection visuelle (5). Par conséquent le passage de l’inspection visuelle manuelle vers les procédés semi-automatisés ou automatisés, par comparaison notamment des résultats obtenus lors du mirage automatisé par rapport au mirage manuel (« Knapp test ») (6), doit faire l’objet d’une grande vigilance. Par exemple, pour les défauts de type particule, il sera important de définir le seuil pour la taille de particule détectable par les opérateurs de production selon des données vérifiables et qui servira de ligne de base pour la qualification des équipements automatisés. Les écarts les plus communément rencontrés dans cette sous-catégorie concernent des capacités de détection du mirage automatique qui ne sont pas au moins égales au mirage manuel, des tests de comparaison entre le mirage manuel et le mirage automatisé qui n’incluent pas l’ensemble des types de défauts rencontrés en production ou le rationnel d’inclusion des défauts qui n’est pas explicité ou enfin, un taux de faux-rejets en qualification de performance de l’équipement semi-automatisé ou automatisé qui n’est pas maitrisé (1). Il est à souligner que les écarts relevés dans cette sous- catégorie nécessitent bien souvent des actions correctives de fond pouvant prendre plusieurs mois car elles nécessitent très souvent une remise en question de l’ensemble des procédés d’inspection visuelle.
Conclusion
L’inspection visuelle présente, comme nous l’avons vu, un pourcentage important de déficiences relevées au cours des inspections BPF. Malgré les avancées technologiques de détection des défauts et l’automatisation des opérations de mirage, les fondamentaux du mirage ne doivent pas être pour autant négligés. L’évolution récente des textes normatifs et réglementaires devrait améliorer grandement la compréhension des attentes des autorités de santé en matière d’inspection visuelle.
L’observation en routine des opérations de mirage manuel et automatisé doit conduire à un certain nombre d’interrogations essentielles, telles que :
- Le contrôle individuel à 100% permet-il la détection de tout corps étranger ou tout défaut ? (pour les défauts connus par l’industriel) ;
l’inspection visuelle manuelle est-elle toujours la référence utilisée pour les opérations de mirage semi-automatique et automatique ; et plus particulièrement pour des équipements anciennement qualifiés ?
- La formation et l’habilitation du personnel ont-elles été réalisées selon des cadences établies en qualification et appliquées en production ?
- L’ensemble des défauts a-t-il été collecté dans la mesure du possible de la production, et dans le cas contraire, existe-t-il une justification pour la création des défauts ?
- La gestion des défauthèques et la création des défauts le cas échéant, font-elles l’objet de procédures détaillées et applicables ? Quid de leur maintien dans le temps ?
- Le comparatif (« Knapp test » ou équivalent) entre le mirage manuel et automatique est-il robuste ? Les résultats sont-ils cohérents ? Les défauts intégrés dans le « Knapp test » ont-ils fait l’objet d’une justification et sur quelles bases ?
- Une réhabilitation annuelle des opérateurs ainsi qu’une requalification périodique des équipements sont-elles prévues et sur quelles bases ?
Enfin, il est important de souligner que, dans cette étude, nous nous sommes essentiellement attachés aux méthodes de détection des défauts déjà existants en production, il est important de rappeler que la prévention de l’apparition des défauts revêt une grande importance et que l’inspection visuelle est un processus complet qui doit prendre en compte chacune des étapes de production (matières premières, articles de conditionnement, conditions de production, etc.) susceptibles de générer des particules et de mettre en place les moyens de les prévenir.
Partager l’article
ANSM
Références
[1] European Pharmacopoiea, Recommandations on testing of particulate contamination : visible particles (5.17.2.) (Draft for consultation) 2019
[2] EMA, Eudralex volume 4 Annex 1 2008
[3] EMA, Eudralex volume 4 Part 4 GMP Requirements for Advanced Therapy Medicinal Products
[4] USP (1790) Visual Inspection of injections 2017
[5] EMA, Eudralex volume 4 Annex 1 (Draft for consultation) 2020
[6] Julius Z. Knapp and Harold K. Kushner, Generalized Methodology for Evaluation of Parenteral Inspection Procedures, Journal of Parenteral Drug Association, January- February, 1980, Vol 34, No 1.