Sommaire
- La campagne on y gagne ! Le travail en mode campagne, une avancée sur la productivité des isolateurs.
- Inspection visuelle : principaux constats des inspections de l’ANSM
- Validation des nettoyages des équipements de production : Contrôle visuel, habilitation du personnel au « visuellement propre »
- A Refresher on Disinfectant Wet Contact Time
- RDM et RDIV de l’UE : Les produits combinés désormais soumis au même degré de surveillance que les dispositifs médicaux autonomes
- Fiabilité de la lignée monocytaire Mono-Mac-6 pour la détection des pyrogènes endotoxiniques et non-endotoxiniques
- Indicateurs biologiques, pousses aléatoires - votre cycle de décontamination est-il réellement en cause ?
- Determining a Strategy for Container Closure Integrity Testing of Sterile Injectable Products
- Efficient Control Strategy enabled by structured Knowledge
- Une solution performante pour les dénombrements en temps réel des colonies sur membranes dans l’analyse microbiologique avec ScanStation
Fiabilité de la lignée monocytaire Mono-Mac-6 pour la détection des pyrogènes endotoxiniques et non-endotoxiniques
Le test de détection de pyrogènes fait partie des tests libératoires obligatoires pour les médicaments stériles à usage parentéral.
A ce jour, les deux méthodes de test majoritairement utilisés sont le test de détection des endotoxines bactériennes et le test pyrogène sur lapin.
Une autre méthode de test de détection de pyrogène, le test d’activation monocytaire (MAT), s’appuie sur l’utilisation de cellules monocytaires humaines pour reproduire la réaction pyrogénique de l’Homme in vitro.
Le MAT peut s’appuyer sur l’utilisation de sang total, de monocytes isolés ou
encore de la lignée cellulaire Mono-Mac 6 (MM6).
La lignée cellulaire MM6, validée pour son utilisation pour le test MAT et listée parmi les sources de monocytes valides pour le MAT dans la Pharmacopée Européenne a parfois été remise en question pour sa capacité à détecter les pyrogènes de nature non endotoxinique (NEPs). Pour démontrer sa performance, des tests ont été réalisés sur un panel de ligand pour l’ensemble des récepteurs monocytaires Toll-Like (TLRs).
1. Mécanisme d’action des pyrogènes
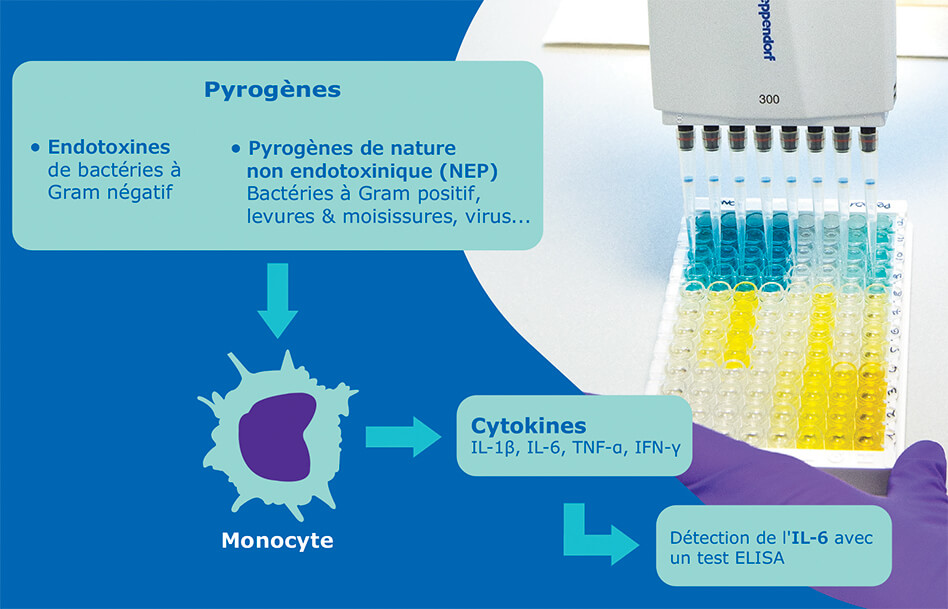
Les pyrogènes déclenchent une réaction de fièvre par l’activation du système immunitaire inné, et plus précisément par l’activation des monocytes. Ces globules blancs reconnaissent les antigènes grâce à leurs récepteurs appelés récepteurs de reconnaissance de motifs (pattern recognition receptors, PRR). L’activation de ces récepteurs entraine une production de pyrogènes endogènes comme les cytokines, qui ont un effet direct sur la régulation de la température corporelle au niveau de l’hypothalamus.
Les substances pyrogènes, provenant de sources variées (bactéries, virus, levures et moisissures), sont reconnues par un type de PRR spécifique appelé récepteurs toll-like (toll-like receptor, TLR) exprimés par les monocytes. Les composants de la paroi cellulaire bactérienne sont reconnus par des TLRs de surface, alors que les acides nucléiques sont reconnus par des TLRs intracellulaires.
La diversité des récepteurs TLR ainsi que la spécificité de chaque sous-type de TLR pour différents ligands suggèrent que la réaction de fièvre observée chez l’homme peut être provoquée non seulement par le lipopolysaccharide (LPS), mais aussi par de nombreuses autres substances provenant de bactéries à Gram négatif et positif, de virus, levures, moisissures ou encore parasites.
Les pyrogènes sont généralement classifiés en deux groupes : les endotoxines (LPS des bactéries à Gram négatif) et les pyrogènes de nature non endotoxinique (non-endotoxin pyrogens, NEPs).
2. Détection des pyrogènes
Les substances pyrogènes présentes dans les produits pharmaceutiques injectables peuvent induire une réaction fébrile grave après administration. Ainsi, il est obligatoire de tester ces produits injectables avant libération en vérifiant l’absence de pyrogènes pour garantir la qualité du produit et la sécurité du patient.
Aujourd’hui, plusieurs méthodes de test sont disponibles pour la détection des pyrogènes dans les échantillons pharmaceutiques. La méthode majoritairement utilisée reste le test de détection des endotoxines bactériennes (Bacterial Endotoxin Test, BET), malgré sa spécificité pour un contaminant unique, le LPS, provenant des bactéries à Gram négatif et ciblant le TLR4 des cellules monocytaires.
Pour assurer la détection d’une large gamme de contaminants pyrogéniques, le test pyrogène sur lapin (Rabbit Pyrogen Test, RPT) peut être utilisé. Cependant, sa faible robustesse et la nécessité de recourir à l’usage d’animaux pour réaliser le test lui confèrent des inconvénients notoires qui vont a l’encontre des lignes de conduite du concept 3R (replacement, réduction, refinement / remplacer, réduire, affiner) présent dans la pharmacopée européenne.
Le test d’activation monocytaire (MAT) reste à ce jour la seule méthode permettant d’évaluer la pyrogénicité d’un échantillon par un test in vitro, en utilisant des cellules monocytaires humaines. Ce test permet de reproduire la réaction immunitaire du corps humain : en présence de pyrogènes, les monocytes sont activés et produisent des cytokines comme l’interleukine-6, qui peuvent ensuite être quantifiées avec un test ELISA.
Pour réaliser un test MAT, plusieurs sources de monocytes humains peuvent être utilisées : le sang total, des monocytes isolés du sang ou encore une lignée cellulaire de monocytes. A ce jour seule la lignée cellulaire Mono-Mac-6 (MM6) a été validée pour son usage dans le test MAT. Toutes ces sources de monocytes sont citées dans le chapitre 2.6.30 (MAT) de la Pharmacopée Européenne comme des sources valides pour le MAT. Cependant, l’utilisation de la lignée cellulaire a parfois été remise en question concernant sa capacité à détecter des pyrogènes de type non endotoxinique (NEPs).
3. Fiabilité des cellules MM6 pour la détection de NEPs
Plusieurs tests ont été réalisés afin de démontrer la capacité des cellules MM6 à détecter un panel de ligands ciblant l’ensemble des TLRs de surface et intracellulaires. Pour réaliser ces tests, le système PyroMAT®, un kit prêt à l’emploi, a été utilisé.
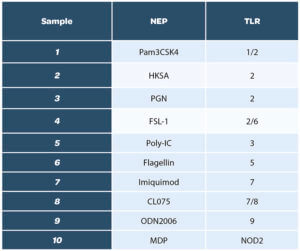
Nous avons choisi une liste variée de ligands pour avoir un panel le plus large possible, en addition avec ceux cités dans le chapitre 2.6.30 de la section 6-3 de la pharmacopée. Un total de dix ligands a été évalué afin de couvrir l’intégralité des TLRs monocytaires :
Avant de réaliser cette étude, la concentration de test de chaque ligand a été déterminée et choisie afin de correspondre à la gamme de quantification de la méthode de test. Par ailleurs, les ligands ont été testés pour vérifier l’absence de contamination en endotoxines.
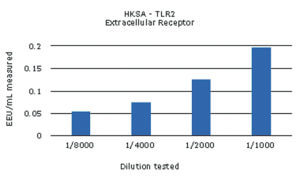
Les différents ligands ont ensuite été évalués à plusieurs doses afin de déterminer leurs limites de détection respectives dans le test MAT. Pour cela, au moins quatre dilutions de chaque NEP ont été testées individuellement. Un exemple de résultat obtenu avec l’échantillon de HKSA est présenté ci-dessous* :
Les différents NEPs testés ont tous été détectés, avec des valeurs supérieures au seuil de détection du test. Les ligands MDP et ODN2006 ont pu être détectés mais pas quantifiés, leur concentration calculée étant inférieure à la limite de quantification du test, 0.05 EU/mL.
De manière générale, les NEPs reconnus par un récepteur cellulaire membranaire ont montré une augmentation dose-dépendante de la pyrogénicité. Cette relation dose-dépendante s’est trouvée moins marquée pour les pyrogènes ciblant des récepteurs intracellulaires. Cela indique que le processus d’internalisation de la molécule est un facteur important pour la réaction pyrogène et que la quantification des NEPs à action intracellulaire peut être affectée par l’internalisation du ligand.
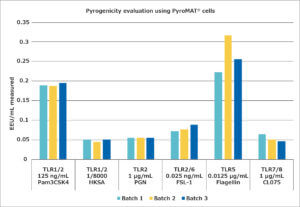
Après avoir déterminé les concentrations en NEPs adaptées pour le test d’activation monocytaire, la stabilité de la réaction avec différents lots de cellules PyroMAT® a été évaluée. Pour cette évaluation, seuls les pyrogènes provoquant une réponse dose-dépendante ont été utilisés. En effet cette condition est nécessaire pour observer une influence éventuelle de la réactivité cellulaire sur la quantification du contaminant. Les résultats sont décrits ci-dessous :
Les différents lots de cellules ont montré la même réactivité aux ligands testés, confirmant la stabilité et la standardisation de la réactivité de la lignée cellulaire Mono-Mac-6.
4. Effets synergétiques potentiels de combinaisons de pyrogènes
Les tests réalisés avec un contaminant pyrogénique peuvent amener un biais car les contaminations dans les produits pharmaceutiques ou les dispositifs médicaux proviennent rarement d’un pyrogène unique. Même lorsqu’un microorganisme unique contamine un produit, plusieurs récepteurs TLRs peuvent être impliqués, ciblant différents éléments de la paroi cellulaire (eg, dans le cas d’une bactérie à flagelle).
Un avantage majeur du test MAT est sa capacité à évaluer la réponse immunitaire globale des cellules monocytaires, résultant en une évaluation efficace de la pyrogénicité d’un mélange de pyrogènes chez l’Homme.
Ce phénomène de synergie potentielle a été analysé en ajoutant une faible quantité d’endotoxine (limite de détection) de l’essai à différents ligands précédemment testés, eux aussi en faible quantité (limite de détection). Les résultats révèlent un effet synergétique pour certains pyrogènes, qu’ils soient reconnus par des récepteurs membranaires ou intracellulaires. Cet effet n’a pas été observé pour l’imiquimod.
L’effet de synergie est également dépendant de la dose d’endotoxine ajoutée aux NEPs. Cela peut donc être à l’origine d’une non-linéarité importante des résultats obtenus avec plusieurs dilutions d’un même échantillon contaminé par plusieurs pyrogènes. Cela renforce donc l’importance de tester, tant que possible, la dilution la plus faible (concentration élevée) de l’échantillon pour laquelle il n’y a pas d’interférence avec la méthode de test. Cette dilution doit être définie lors de la validation spécifique au produit.
Conclusion
Dans cette étude, nous avons démontré que les cellules Mono-Mac-6 utilisées dans le système PyroMAT® peuvent détecter un panel de ligands pour les TLRs, y compris intracellulaires. Le MAT avec le système PyroMAT® permet d’obtenir une réaction reproductible pour le standard endotoxine et les NEPs.
De plus, il permet d’apprécier une activation synergétique de multiples TLRs en présence par exemple d’endotoxine et d’un autre ligand NEP. Cet essai permet donc de détecter une contamination provenant de pyrogènes isolés ou en combinaisons afin de prédire la réponse pyrogène du système immunitaire humain.
Partager l’article
Laure Robert – Merck
laure.robert@merckgroup.com
Glossaire
NEP : Non Endotoxin Pyrogens, endotoxines non pyrogènes) comme les virus, levures ou particules.
TLR : Recepteurs Toll like qui avertissent le système immunitaire de potentielles infections.
Références
1. European Pharmacopoeia, chapter Monocyte activation test (2.6.30)
2. Akira, S.et al. 2006. Pathogen recognition and innate immunity. Cell 124, 783-801.
3. Beutler, B:A. (2009). TLRs and innate immunity. Blood 113, 1399-1407.
4. Kawai and Akira 2011. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity. Immunity 34, 637-650.
5. Henderson, B. and Wilson, M. 1996. Cytokine induction by bacteria: beyond lipopolysaccharide. Cytokine 8, 269-282.
6. Takeuchi, O. et al. Cutting edge: Role of Toll-like receptor 1in mediating immune response to microbial lipoproteins. J. Immunol. 169, 10–14 (2002).
7. Wyllie, D. H. et al. Evidence for an accessory protein function for Toll-like receptor 1 in anti-bacterial responses. J. Immunol. 165, 7125–7132 (2002).
8. Aliprantis, A. O. et al. Cell activation and apoptosis by bacterial lipoproteins through Toll-like receptor 2. Science 285, 736–739 (1999).
9. Takeuchi, O. et al. Differential roles of TLR2 and TLR4 in recognition of Gram-negative and Gram-positive cell wall components. Immunity 11, 443–451 (1999).
10. Schwadner, R. et al. Peptidoglycan- and lipoteichoic acid-induced cell activation is mediated by Toll-like receptor 2. J. Biol. Chem. 274, 17406–17409 (1999).
11. Schwadner, R. et al. Peptidoglycan- and lipoteichoic acid-induced cell activation is mediated by Toll-like receptor 2. J. Biol. Chem. 274, 17406–17409 (1999).
12. Means, T. K. et al. Human Toll-like receptors mediate cellular activation by Mycobacterium tuberculosis. J. Immunol. 163, 3920–3977 (1999).
13. Hajjar, A. M. et al. Cutting Edge: Functional interactions between Toll-like receptor (TLR) 2 and TLR1 or TLR6 in response to phenol-soluble modulin. J. Immunol. 166, 15–19 (2001).
14. Coelho, P. S. et al. Glycosylphosphatidylinositol-anchored mucin-like glycoproteins isolated from Trypanosoma cruzi trypomastigotes induce in vivo leukocyte recruitment dependent on MCP-1 production by IFN-γ-primedmacrophages. J. Leukoc. Biol. 71, 837–844 (2002).
15. Opitz, B. et al. Toll-like receptor-2 mediates Treponema glycolipid and lipoteichoic acid-induced NF-κB translocation. J. Biol. Chem. 276, 22041–22047 (2001).
16. Massari, P. et al. Cutting edge: Immune stimulation by Neisserial porins is Toll-like receptor 2 and MyD88 dependent. J. Immunol. 168, 1533–1537 (2002).
17. Werts, C. et al. Leptospiral liopolysaccharide activates cells through a TLR2-dependent mechanism. Nature Immunol. 2, 346–352 (2001).
18. Hirschfeld, M. et al. Signaling by Toll-like receptor 2 and 4 agonists results in differential gene expression in murine macrophages. Infect. Immun. 69, 1477–1482 (2001).
19. Underhill D. M. et al. The Toll-like receptor 2 is recruited to macrophage phagosomes and discriminates between pathogens. Nature 401, 811–815 (1999).
20. Asea, A. et al. Novel signal transduction pathway utilized by extracellular HSP70: role of Toll-like receptor (TLR) 2 and TLR4. J. Biol. Chem. 277, 15028–15034 (2002).
21. Alexopoulou, L., Holt, A. C., Medzhitov, R. & Flavell, R. A. Recognition of double-stranded RNA and activation of NF-κB by Toll-like receptor 3. Nature 413, 732–738 (2001).
22. Poltorak, A. et al. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene. Science 282, 2085–2088 (1998). The first report that TLR4 is involved in the recognition of bacterial components.
23. Kawasaki, K. et al. Mouse Toll-like receptor 4–MD-2 complex mediates lipopolysaccharide-mimetic signal transduction by taxol. J. Biol. Chem.
275, 2251–2254 (2000).
24. Kurt-Jones, E. A. et al. Pattern recognition receptors TLR4 and CD14 mediate response to respiratory syncytial virus. Nature Immunol. 1, 398–401 (2000).
25. Rassa, J. C. et al. Murine retroviruses activate B cells via interaction with Toll-like receptor 4. Proc. Natl Acad. Sci. USA 99, 2281–2286 (2002).
26. Bulut, Y. et al. Chlamydial heat shock protein 60 activates macrophages and endothelial cells through Toll-like receptor 4 and MD2 in a MyD88-dependent pathway. J. Immunol. 168, 1435–1440 (2002).
27. Ohashi, K., Burkart, V., Flohe, S. & Kolb, H. Cutting edge: Heat shock protein 60 is a putative endogenous ligand of the Toll-like receptor-4 complex. J. Immunol. 164, 558–561 (2000).
28. Vabulas, R. M. et al. HSP70 as endogenous stimulus of the Toll/interleukin-1 receptor signal pathway. J. Biol. Chem. 277, 15107–15112 (2002).
29. Okamura, Y. et al. The extra domain A of fibronectin activates Toll-like receptor 4. J. Biol. Chem. 276, 10229–10233 (2001).
30. Termeer, C. et al. Oligosaccharides of hyaluronan activate dendritic cells via Toll-like receptor 4. J. Exp. Med. 195, 99–111 (2002).
31. Johnson, G. B., Brunn, G. J., Kodaira, Y. & Platt, J. L. Receptor-mediated monitoring of tissue well-being via detection of soluble heparan sulfate by Toll-like receptor 4. J. Immunol. 168, 5233–5239 (2002).
32. Smiley, S. T., King, J. A. & Hancock, W. W. Fibrinogen stimulates macrophage chemokine secretion through Toll-like receptor 4. J. Immunol. 167, 2887–2894 (2001).
33. Hayashi, F. et al. The innate immune response to bacterial flagellin is mediated by Toll-like receptor-5. Nature 410, 1099–1103 (2001).
34. Takeuchi, O. et al. Discrimination of bacterial lipopeptides by Toll-like receptor 6. Int. Immunol. 13, 933–940 (2001).
35. Schwadner, R. et al. Peptidoglycan- and lipoteichoic acid-induced cell activation is mediated by Toll-like receptor 2. J. Biol. Chem. 274, 17406–17409 (1999).
36. Ozinsky, A. et al. The repertoire for pattern recognition of pathogens by the innate immune system is defined by cooperation between Toll-like receptors. Proc. Natl Acad. Sci. USA 97, 13766–13771 (2000).
37. Hemmi, H. et al. Small anti-viral compounds activate immune cells via the TLR7 MyD88-dependent signaling pathway. Nature Immunol. 3, 196–200 (2002).
38. Heil, F. et al. The Toll-like receptor 7 (TLR7)-specific stimulus loxoribine uncovers a strong relationship within the TLR7, 8 and 9 subfamily.
Eur. J. Immunol. 33, 2987–2997 (2003).
39. Heil, F. et al. The Toll-like receptor 7 (TLR7)-specific stimulus loxoribine uncovers a strong relationship within the TLR7, 8 and 9 subfamily. Eur. J. Immunol. 33, 2987–2997 (2003).
40. Heil, F. et al. Species-specific recognition of single-stranded RNA via Toll-like receptor 7 and 8. Science 303, 1526–1529 (2004).
41. Diebold, S. S., Kaisho, T., Hemmi, H., Akira, S. & Reis e Sousa, C. Innate antiviral responses by means of TLR7-mediated recognition of single-stranded RNA. Science 303, 1529–1531 (2004).
42. Jurk, M. et al. Human TLR or TLR8 independently confer responsiveness to the antiviral compound R-848. Nature Immunol. 3, 499 (2002).
43. Heil, F. et al. Species-specific recognition of single-stranded RNA via Toll-like receptor 7 and 8. Science 303, 1526–1529 (2004).
44. Hemmi, H. et al. A Toll-like receptor recognizes bacterial DNA. Nature 408, 740–745 (2000).
45. Zhang, D. et al. A Toll-like receptor that prevents infection by uropathogenic bacteria. Science 303, 1522–1526 (2004).
46. Science 303. (5663):1526-9.
47. Uematsu S., Akira S. (2008) Toll-Like Receptors (TLRs) and Their Ligands. In: Bauer S., Hartmann G. (eds) Toll-Like Receptors (TLRs) and Innate Immunity. Handbook of Experimental Pharmacology, vol 183. Springer, Berlin, Heidelberg.Manufacturing Practice, 2004